上海金畔生物科技有限公司代理Takara Clontech酶试剂盒全线产品,欢迎访问官网了解更多产品信息和订购。
| 基因敲入用长单链DNA制备 v2 | ||||||
| 品牌 | Code No. | 产品名称 | 包装量 | 价格(元) | 说明书 | 数量 |
| Clontech | 632666 | Guide-it™ Long ssDNA Production System v2 | 50 Rxns | ¥6,647 | |
  |
收藏产品 加入购物车
| Guide-it Long ssDNA Production System v2可以让您根据需求,制备长至5,000 nt的长单链DNA(ssDNA),作为修复模板用于多种基因组编辑技术的基因敲入实验。该试剂盒提供了一种简单且快速的方法,通过选择性消化正义链(sense strand)或者反义链(antisense strand),可以将任何序列的dsDNA PCR产物转化成为ssDNA。每个试剂盒可制备50条ssDNA模板。 尽管在利用同源定向修复(HDR)进行准确基因组编辑的应用中,单链DNA(ssDNA)修复模板展示出了优于双链DNA(dsDNA)模板的众多优势(Roth et al., 2018)。但由于制备难度和制备成本的原因,长单链DNA(long ssDNA)的应用受到了限制。Guide-it Long ssDNA Production System v2提供了一种高效经济的方法,可以根据自己的实验需求制备ssDNA,让所有研究人员都可以体验ssDNA模板的优势。 |
||||||||||||||||||||||||||||||||||
| 与dsDNA相比,使用ssDNA作为模板的优势: |
||||||||||||||||||||||||||||||||||
| · 显著减少了随机整合和脱靶整合,从而提高了基因编辑效率,降低了出现实验伪像的可能性 · 细胞毒性更低,让您收获到更多的编辑细胞 · 由于来自非整合模板的转基因表达微乎其微,因此更容易识别出正确编辑克隆 |
||||||||||||||||||||||||||||||||||
| 与原版本产品Guide-it Long ssDNA Production System(Code No. 632644)相比,优化了反应体系,进一步提高了链消化酶(Strandase)处理效率,即便是以往制备困难具有挑战性的dsDNA模板,也可以高效制备ssDNA。 |
||||||||||||||||||||||||||||||||||
| ■ 产品特点 | ||||||||||||||||||||||||||||||||||
| · 根据需求制备500–5,000 nt ssDNA供体模板,用于基因敲入实验 · 操作流程简单快速,只需几个小时即可完成 · 与dsDNA模板相比,脱靶整合显著降低 · 细胞毒性更低,编辑后的细胞群细胞活力更高 |
||||||||||||||||||||||||||||||||||
| ■ 实验操作流程图 | ||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||
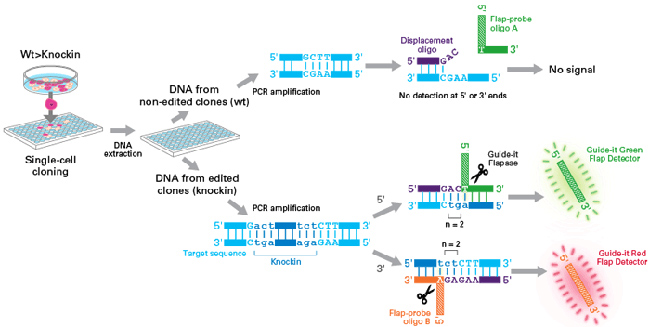
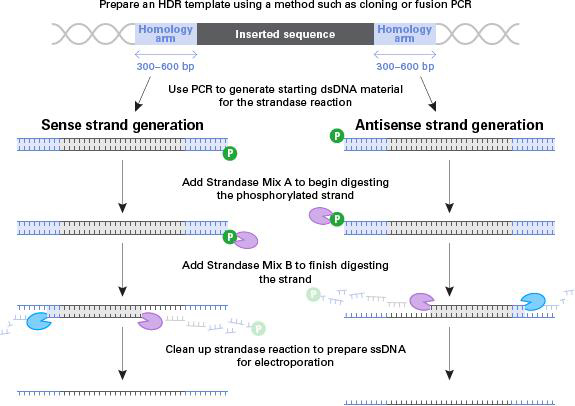
| 图1. 用于基因敲入实验的长单链DNA(long ssDNA)供体模板制备流程。首先,使用克隆、融合PCR或者其它方法制备dsDNA模板,dsDNA模板除了包含目的基因之外,还需要包含长度为300-600 bp的同源臂,该同源臂与目的插入位点左右两侧的相邻序列相同源。接着,只在一端使用磷酸化引物进行PCR扩增,制备两种不同的dsDNA PCR产物(分别作为正义链ssDNA和反义链ssDNA制备模板)。添加链消化酶A(Strandase Mix A),开始消化降解正义链或反义链。由于链消化酶A只消化降解5’端被磷酸化的DNA链,所以可以有选择性地降解正义链或反义链。然后,添加链消化酶B(Strandase Mix B)完成消化反应获得ssDNA。最后,纯化反应液,准备适用于后续基因敲入实验的ssDNA供体。请注意,如果正向引物被磷酸化,则生成的ssDNA将是反义链;反之,如果反向引物被磷酸化,最终产物将是正义链。建议制备正义链和反义链两种ssDNA,分别进行基因敲入实验。 | ||||||||||||||||||||||||||||||||||
| ■ 实验例 | ||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||
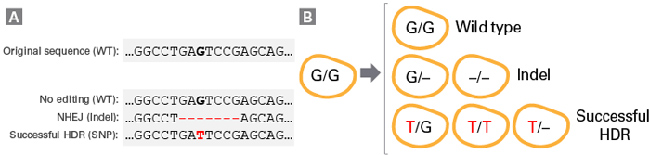
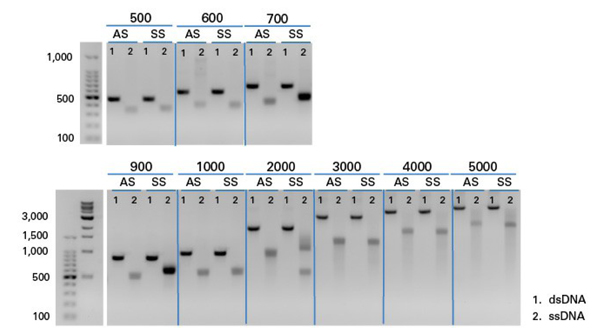
| 图2. Guide-it Long ssDNA Production System v2提升了挑战性模板的处理能力和长至5,000 nt单链DNA的制备能力。Guide-it Long ssDNA Production System v2可成功制备长度为500 nt至5,000 nt的ssDNA。凝胶图显示了不同长度的dsDNA底物(泳道1),经过酶消化和纯化后相对应的正义(SS)和反义(AS)ssDNA产物(泳道2)。每个ssDNA HDR模板均设计为靶向CCR5基因。 | ||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||
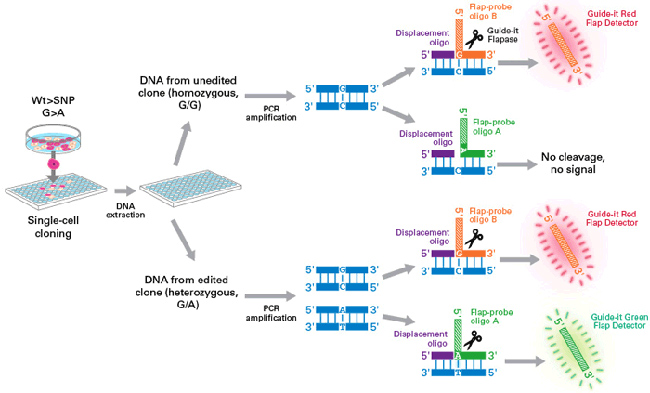
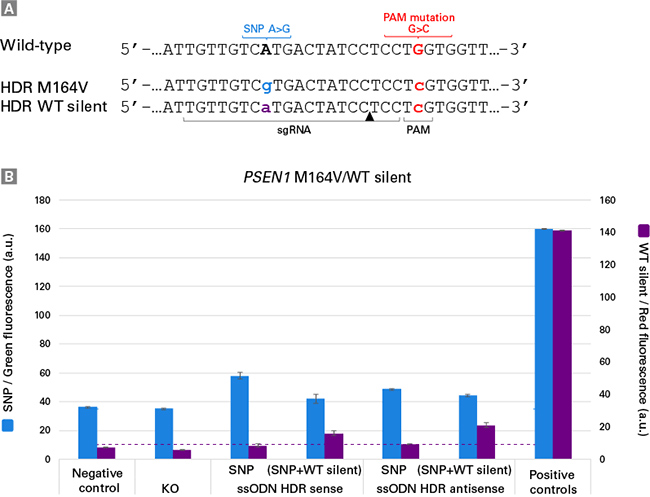
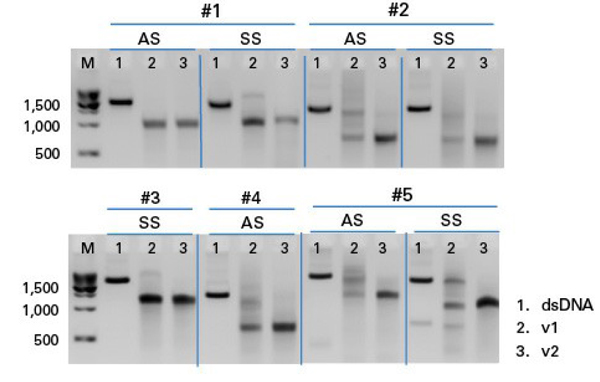
| 图3. Guide-it Long ssDNA Production System v2优化了ssDNA制备效率,可更有效处理具有挑战性的dsDNA模板。凝胶图显示了几种HDR模板的dsDNA起始材料(Lane 1)和正义(SS)或反义(AS)ssDNA产物,这些ssDNA分别使用了Guide-it Long ssDNA Production System原版本产品(v1)或升级版本产品(v2)进行制备( Lane 2和Lane 3)。对于v1 Guide-it试剂盒,本实验例所包含的dsDNA模板,已被鉴定为具有挑战性的ssDNA制备底物,很难制备出高纯度ssDNA。以溴化乙锭为染色剂,采用琼脂糖凝胶电泳法分析dsDNA和ssDNA。ssDNA产物的分子量要比相应dsDNA底物的分子量小。在所有情况下,Guide-it Long ssDNA Production System v2制备的ssDNA条带比v1版本更清晰,表明消化更完全、更均匀。 | ||||||||||||||||||||||||||||||||||
| ■ 产品组份 | ||||||||||||||||||||||||||||||||||
| Guide-it Long ssDNA Production System v2(Code No. 632666) | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| * 本产品不单独出售。 | ||||||||||||||||||||||||||||||||||
| ■ 保存条件 | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| ■ 关联资料 | ||||||||||||||||||||||||||||||||||
| 相关资料: 点击图片下载 |
 |
|||||||||||||||||||||||||||||||||
| 产品详情请点击: |
||||||||||||||||||||||||||||||||||

.png)
.png)
.png)
.png)
.png)
.png)
.png)