W260/UV/10MM SEMIMICRO CELL
货号:662620
规格:QUARTZ UV
品牌: Lovibond/Orbeco
报价:¥2059.00

货号:662620
规格:QUARTZ UV
品牌: Lovibond/Orbeco
报价:¥2059.00
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| FDV-0017 | CytoSeeing CytoSeeing<可逆细胞质蓝> |
1 mg |
![]()
可清洗去除的细胞染色探针
CytoSeeing<Reversible Cytoplasm Blue>
CytoSeeing是一种新型细胞染色试剂,只需添加到培养基即可迅速对细胞质进行染色。荧光观察细胞质后,只需更换不含CytoSeeing的培养基,便可轻松去除细胞内的荧光染色。
※本产品基于北海道大学研究生院理学研究科的研究成果商品化而成。
※本产品仅供研究,研究以外不可使用。
◆关于CytoSeeing
已知细胞核与细胞质的形态变化与细胞分化、功能、信号反应相关。传统的细胞质染色探针,主要作为细胞示踪剂使用,一旦摄入细胞,即使去除培养基中的试剂也会残留在细胞内。随后,细胞内的染色试剂随着细胞分裂的过程逐渐褪色,通常在3~6代左右便会消失。但是如果染色试剂残留在细胞内的话,实时成像观察细胞质与细胞核的形态后,难以立即使用其他探针进行成像。
不同于传统试剂,CytoSeeing是一种仅对细胞质进行染色且可清洗的细胞染色试剂。
参考文献:
Kamada, et al., PLOS ONE, 11:e0160625(2016).
◆特点
● 只需添加到培养基即可对细胞质进行染色。
● 染细胞质,但不会进入细胞核内。可以通过细胞核的边界对其进行形态学上的观察。例如,适用于活细胞中血细胞的细胞核形态观察。
● 可使用DAPI滤光片进行检测,且能够与GFR和RFP等绿色或红色荧光物质同时使用。
● CytoSeeing的可视化不会影响细胞功能。
● 通过培养基或PBS清洗摄入细胞的CytoSeeing,可从细胞中去除CytoSeeing。
● 去除CytoSeeing后,可直接用于其他检测。
● 可用于贴壁细胞与悬浮细胞。
与现有的细胞质染色试剂比较
|
染色试剂 |
细胞质染色 |
判别细胞核形态 |
导入细胞内所需时间 |
Wash-out |
|
CytoSeeing |
○ |
○ |
3~9 min |
○ |
|
T公司试剂 |
○ |
× |
15 min~1 h |
× |
|
A公司试剂 |
○ |
× |
15 min~1 h |
× |
◆产品概述
● 分子式:C17H12N3
● 分子量:258.11
● 纯度:≧97%
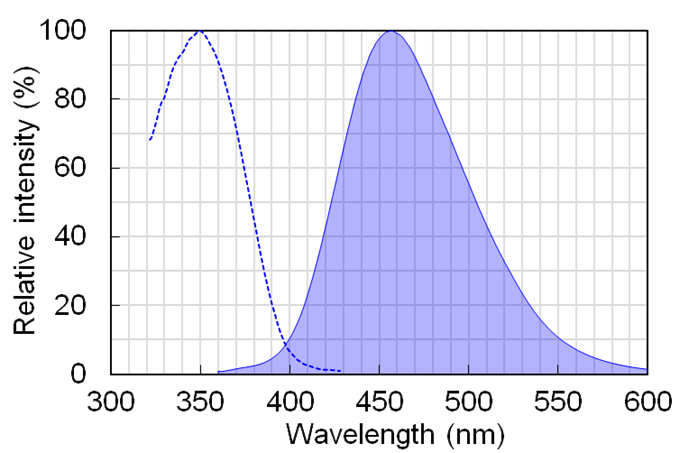
● 激发/荧光波长(Ex/Em)*1:345 nm/456 nm
● 可溶性:DMSO*2
*1 可通过DAPI滤光片进行观察。
*2 建议使用10 mM作为母液。
◆操作方法概要
1. 取适量细胞进行培养;
2. 添加CytoSeeing溶液至培养基中使终浓度为10 μM~50 μΜ;
3. 在适合细胞的温度下孵育几分钟;
4. 使用荧光显微镜进行观察;
5. 去除CytoSeeing时,添加不含CytoSeeing的新鲜培养基清洗。
◆应用实例
|
|
|
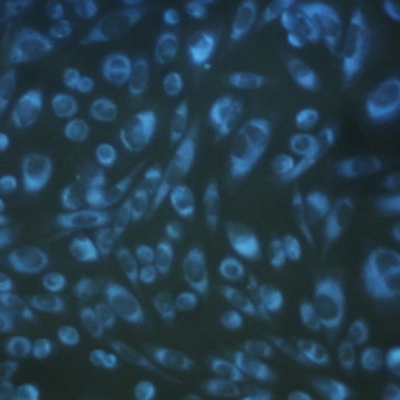
使用CytoSeeing对CHO细胞进行染色
使用CytoSeeing(10 μM)对CHO细胞进行染色30 min。整个细胞质(cytoplasm)被染色,可以通过观察边界来观察细胞核的形态。
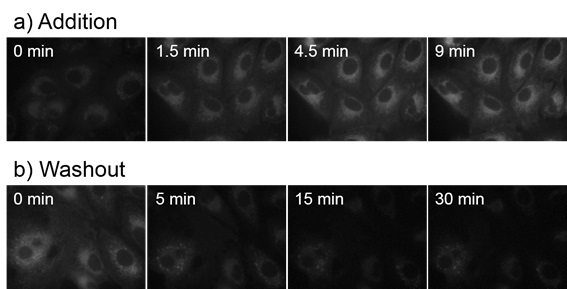
在A549细胞中CytoSeeing的时间依赖性摄取和分布
a)添加CytoSeeing(10 μM)至细胞中,并孵育。仅需9 min,CytoSeeing已被充分摄入到细胞内。
b)使用CytoSeeing(10 μM)染色细胞后,更换到不含CytoSeeing的培养基中孵育。仅需30 min CytoSeeing便脱离细胞。
货号:VP 540-1
品牌: V&P Scientific
报价:¥2230.00
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| FDV-0029 | NucleoSeeing NucleoSeeing活细胞核绿色荧光染料 |
0.1 mg |
DNA特异性细胞核实时成像试剂![]()
NucleoSeeing <Live Nucleus Green>
NucleoSeeing是与DNA特异性结合并发出绿色荧光的实时成像用细胞核染色试剂。不仅是动物细胞和组织,拟南芥的叶细胞中也显示出高S/N比,并可很好的观察活细胞中细胞核动态。另外,还可用作细胞核pH sensor。
※本产品基于名古屋工业大学的研究成果商品化而成。
※本产品仅供科研使用。严禁用于科研以外用途。

使用了NucleoSeeing的各种样本的染色案例
将HeLa细胞(左),拟南芥表皮细胞和保卫细胞(中),小鼠脑海马切片培养(右)活细胞成像后进行观察。详情请参考各个案例的数据。
◆活细胞的细胞核成像
MEMO
细胞核作为DNA的储存库负责细胞分裂和控制基因表达,是细胞中最重要的细胞器之一。因此细胞核动力学的动态实时成像就成为了非常重要的课题。从以前开始就开发了各种核染色试剂,虽然核酸应答性的蓝色荧光色素Hoechst系列和DAPI被广泛运用,但由于这些蓝色荧光素使用紫外线作为激发光,光毒性强,存在不适用于活细胞成像的问题。最近,虽然开发了一些适用于活细胞的核染料,如绿色和红色荧光色素,但是化合物的细胞毒性和核染色的特异性仍然存在问题。
NucleoSeeing是名古屋工业大学的筑地真也教授等人开发的DNA特异性绿色荧光化合物,可以在细胞培养,组织培养以及拟南芥叶等的植物细胞中进行活细胞成像。本产品细胞毒性低,DNA特异性显示高S/N比,以及优异的细胞核染色性能。也可用于观察固定细胞,应用灵活。另外,由于其拥有特殊的pH依存性荧光特性,还可以用作细胞核特异性的pH sensor。近年,在细胞核内pH重要性的研究中,还可以期待本产品作为核内pH检测的专用试剂。
各种细胞核染料的比较参数
|
染色试剂名称 |
光特性 |
化合物的物性 |
观察方法 |
|||||
|
检测波长 |
荧光色 |
光毒性 |
核特异性 |
细胞膜 |
细胞毒性 |
活细胞 |
固定细胞 |
|
|
NucleoSeeing |
488 / 520 |
绿 |
无 |
✔ |
✔ |
无 |
✔ |
✔ |
|
Hoechst |
350 / 461 |
蓝 |
有 |
✔ |
✔ |
有 |
✔ |
✔ |
|
DAPI |
350 / 461 |
蓝 |
有 |
✔ |
× |
不明 |
× |
✔ |
|
X公司产品 |
485 / 498 |
绿 |
✔ |
△ |
✔ |
不明 |
✔ |
✔ |
|
Y公司产品 |
646 / 680 |
红 |
✔ |
✔ |
✔ |
有 |
✔ |
✔ |
◆原理
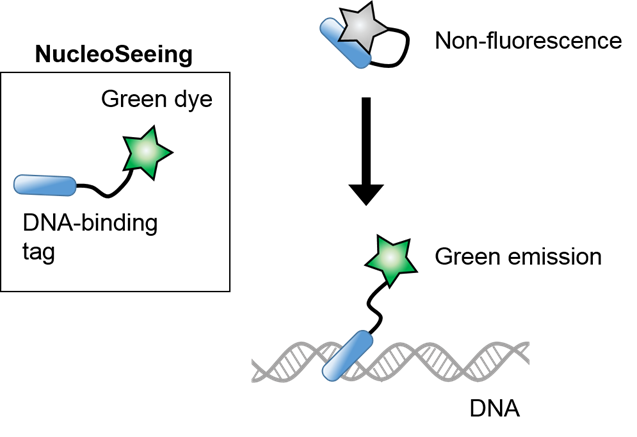
NucleoSeeing是细胞膜渗透性的绿色核染色试剂,由绿色荧光色素和DNA特异性结合tag组成。本产品在DNA不存在时显示折叠构造,虽然有消光状态,但与DNA结合时构造发生改变,发出绿色荧光。由于NucleoSeeing摄入细胞内后与DNA结合时发出绿色荧光,因此可以特异性观察细胞核。
◆特点
● 仅在与DNA结合时发出绿色荧光,显示高S/N比。由于在培养基中会消光,因此在添加了培养基的状态下也可以高灵敏度地进行观察
● ※想要提高灵敏度,则建议染色后更换培养基后再进行观察。
● 激发光/发射光波长:488 nm/520 nm
● 和传统的Hoechst等试剂相比,几乎没有发现细胞毒性。
● 不仅仅是活细胞成像,还可以染色固定细胞,活细胞成像后再固定细胞进行观察,也可以用于免疫染色实验。
● 无论是动物来源的细胞和组织培养,还是植物细胞(拟南芥叶细胞),都可以进行高S/N比的核染色。
● 观察植物细胞时,不受叶绿体来源的自身荧光(Em:>615 nm)的影响,可以仅将细胞核可视化。
● 能够可逆性染色。培养基更换12~24小时后,染料几乎全部被排出细胞外。
● 由于可以看见pH依赖性的荧光强度的变化,所以在pH 6~8之间,可以通过2个波长的荧光强度比
● (Ex 405 nm, Em 520 nm / 460 nm),作为细胞核内的pH sensor使用。
◆应用
● 动物来源培养细胞的活细胞成像
● 植物细胞的活细胞成像
● 免疫染色中的细胞核染色
● 细胞核内pH sensor(pH 6~8)
◆原著论文
※ 本产品NucleoSeeing是以下论文中的hoeAc2FL。
|
1. |
Nakamura, A., et al., Chem. Commun., 50, 6149~6152 (2014) "Hoechst tagging: a modular strategy to design synthetic fluorescent probes for live-cell nucleus imaging." |
|
2. |
Ueda, M., et al., ACS Cent. Sci., 3 (5), 462~472 (2017) "Noncanonical function of a small-molecular virulence factor coronatine against plant immunity: an in vivo raman imaging approach." |
|
3. |
Nakamura, A. and Tsukiji, S., Bioorg. Med. Chem. Lett., 27 (14), 3127~3130 (2017) "Ratiometric fluorescence imaging of nuclear pH in living cells using hoechst-tagged fluorescein." |
◆应用实例
DNA应答性的荧光特性和细胞核特异性染色
左:NucleoSeeing仅在DNA存在时显示出强的绿色荧光。激发光488 nm。
右:在活细胞中,与DNA特异性结合的Hoechst33342(蓝)和NucleoSeeing(绿)进行共染色的结果,
右:显示出高度的一致性。

细胞毒性
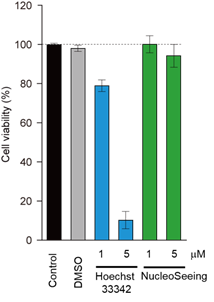
作为蓝色核染色试剂被广泛使用的Hoechst33342和NucleoSeeing,利用MTT法确认其细胞毒性。Hoechst在5 μM时观察到了显著的细胞死亡,而NucleoSeeing在5 μM时还未观察到细胞毒性。
可逆性染色
为了评价Hoechst33342和NucleoSeeing的细胞滞留性,分别用1 μM两种试剂处理15分钟后,更换培养基,去除剩余的试剂,观察24小时荧光强度的变化。Hoechst33342在24小时后依然维持80%的荧光强度,显示出不可逆性,与之相对NucleoSeeing随着时间推移,荧光强度逐渐减弱,12小时以后几乎全部排出。因此,NucleoSeeing可以作为可逆性的核染色试剂使用。

各种培养细胞的核染色
添加1 μM的 NucleoSeeing 至各种培养细胞的培养基中,染色15分钟后,更换培养基观察活细胞,无论哪种细胞都观察到了核特异性的信号。

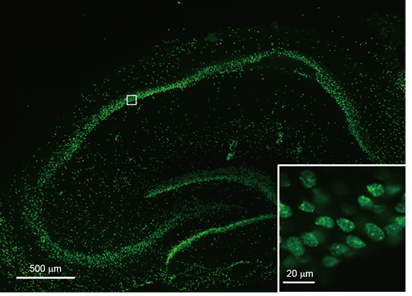
小鼠脑(海马)切片培养组织的染色案例
添加20 μM 的NucleoSeeing至小鼠脑海马切片培养组织的培养基中,染色15分钟后,更换培养基在未固定的条件下进行观察。
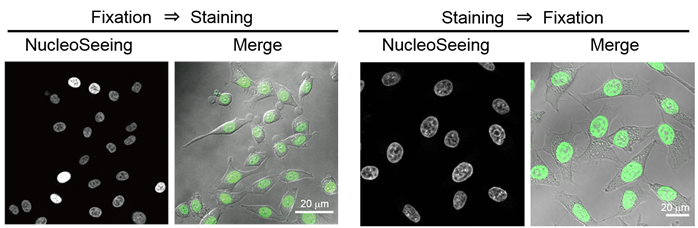
固定细胞的染色案例
左:用4%多聚甲醛固定处理HeLa细胞后,用PBS清洗细胞,添加1 μM的 NucleoSeeing染色15分钟。染色后,清洗并观察。
右:添加5 μM 的NucleoSeeing染色15分钟,用4%多聚甲醛固定细胞并进行观察。
右:※虽然也可用甲醇进行固定,但信号可能会减弱。
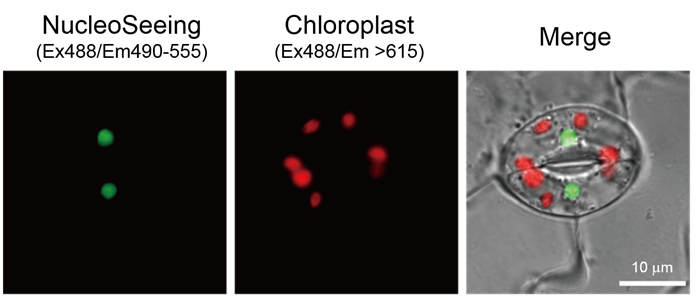
拟南芥叶的保卫细胞染色案例
用20 μM 的NucleoSeeing处理拟南芥叶的切片60分钟后,清洗切片进行观察。激发光为488 nm时,在绿色荧光范围490~555 nm内观察保卫细胞的细胞核,615 nm以上波长范围中观察到叶绿体来源的自身荧光。通过使用本试剂,可以在观察时区分叶绿体的自身荧光和细胞核荧光,期待本品可作为植物细胞的核动态成像试剂使用。
※拟南芥叶的保卫细胞的核染色是由名古屋工业大学的筑地教授等人和东北大学上田实教授等人共同研究发现的成果。
Ueda, M., et al., ACS Cent. Sci., 3 (5), 462~472 (2017)
"Noncanonical function of a small-molecular virulence factor coronatine against plant immunity: an in vivo raman imaging approach."
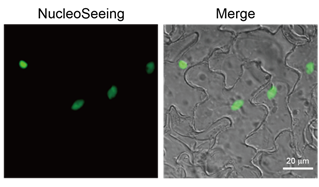
拟南芥叶表皮细胞的染色案例
用20 μM的 NucleoSeeing处理拟南芥叶的切片60分钟后,清洗切片进行观察。确认表皮细胞的核特异性染色。
◆使用NucleoSeeing作为核内pH sensor
细胞核有着由外膜和内膜这两层脂质双分子层膜构成的核膜这种独特结构,与细胞质分隔开来。细胞核内和细胞质之间的物质交流需要通过细胞核孔进行,但学者们认为细胞核内的环境和细胞质的环境是不同的。近年,有学者提出核膜中存在核膜特异性质子泵(H+-ATPase),在细胞核和细胞质之间产生质子梯度。虽然可以期待通过生理现象变化来检测细胞核内的pH值,但是至今还没有开发出十分理想的试剂。
名古屋工业大学筑地教授等人证明NucleoSeeing具有pH依赖性荧光特性,可以作为细胞核传感器使用。NucleoSeeing作为细胞核染色试剂,一般在激发光480 nm/荧光520nm的范围使用,但是在激发光405 nm时使用的话,在460 nm以及520 nm左右的荧光会依赖pH值发生变化。通过检测激发光405 nm时460 nm和520 nm的荧光强度比(F520 / F460),观察pH5.5~8.5之间的S形曲线。利用这个原理,就可以评估细胞核内的pH值。
■ 原著论文
Nakamura, A. and Tsukiji, S., Bioorg. Med. Chem. Lett., 27 (14), 3127~3130 (2017)
"Ratiometric fluorescence imaging of nuclear pH in living cells using hoechst-tagged fluorescein."
◆NucleoSeeing用作细胞核内pH sensor的原理和特点
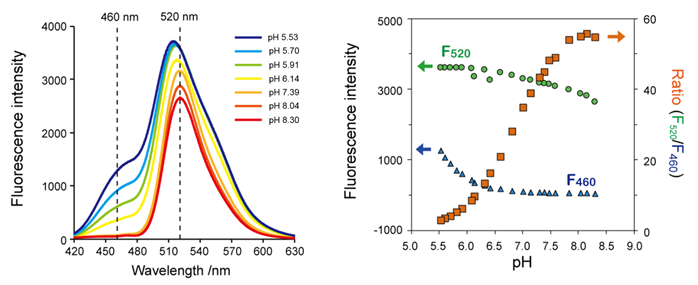
(参考数据)in vitro中NucleoSeeing的pH依赖性荧光特性
左:在NucleoSeeing的激发波长405 nm时荧光光谱和pH依赖性。在pH5.5~8.5之间,460 nm和520 nm附近的荧光强度随着pH值降低而增强。
右:在各pH值中,460 nm和520 nm的荧光强度F(激发波长405 nm)和荧光强度比(F520 / F460)。
<注>NucleoSeeing针对活细胞用的细胞膜渗透性进行了优化,摄入细胞内以后,被酯酶水解并转化为活性本体。本数据是为了验证使用了化学合成的活性本体(NucleoSeeing的水解产物)进行in vitro获得的数据。请注意直接使用NucleoSeeing进行in vitro不可能重现本数据。
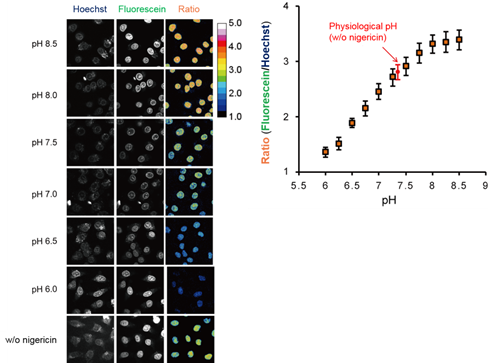
◆在in cellulo中使用NucleoSeeing观察细胞核内pH
用NucleoSeeing染色培养细胞(HeLa细胞)后,用含有K+ / H+离子载体Nigericin * 的pH buffer培养后,用共聚焦显微镜观察在激发光405 nm时的荧光强度比(FFluorescein / FHoechst)
左:各pH值的荧光观察图像
右:定量结果分析与in vitro相同,可以观察到pH依赖性和荧光强度比的对应关系,并且预估生理性(未添加Nigericin)的核内pH值为7.4。
* Nigericin是代表性的K+ / H+离子载体,在细胞外溶液的pH值和细胞内pH值一致时使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| FDV-0042 | LipiRADICAL Green | 0.1 mg | – |

LipiRADICAL Green(检测试剂)/OH-Pen(抑制物质)
脂质过氧化研究的新工具!脂质自由基检测试剂和抑制物质
LipiRADICAL Green是特异性荧光检测脂质过氧化反应的上游因子脂质自由基的试剂。可用于活细胞成像、样品中脂质自由基含量的相对定量以及样品中脂质自由基的结构分析和全面鉴定。另外,OH-Pen还可作为脂质自由基特异性中和剂使用。
※ 本产品基于九州大学大学院药学研究院 生命物理化学领域 山田健一教授的研究结果商品化并销售。
※ 本产品仅供研究用,研究以外不可使用。
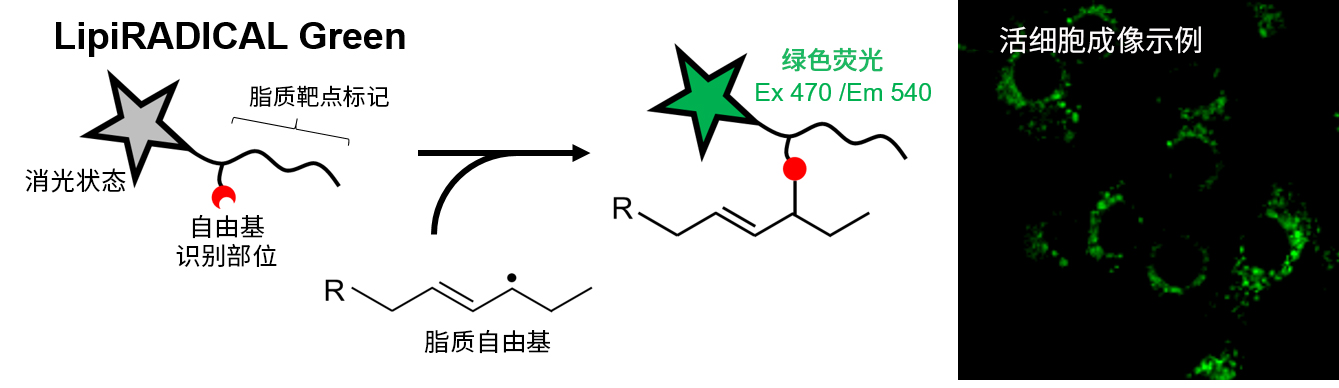
本试剂的概要图和活细胞成像示例
脂质自由基发生特异性反应产生绿色荧光的LipiRADICAL Green原理示意图(左),以及用药物刺激Hepa1-6细胞时的活细胞成像示例(右)。
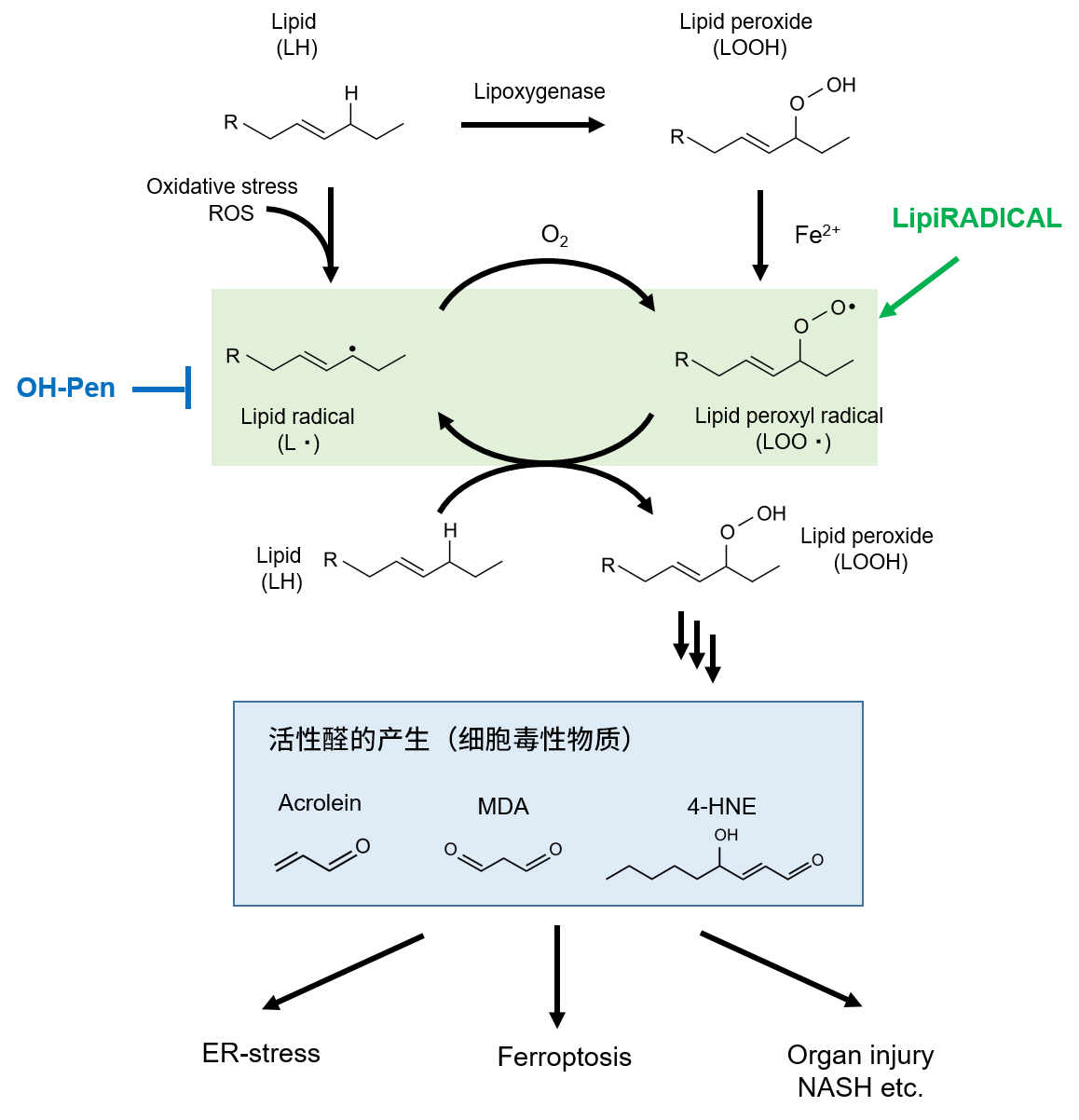
◆什么是脂质过氧化反应(LPO)和脂质自由基(Lipid radical)?
脂质过氧化反应(lipid peroxidation; LPO)是指由于氧化应激脂质被氧化分解的反应,是脂质分解的过程之一。以含有多不饱和脂肪酸(Polyunsaturated fatty acid; PUFA)的脂质为起点,目前已提出两种脂质过氧化反应的发生过程:
1.氧化应激引起的脂质自由基产生
2. Lipoxygenase引起的过氧化脂质生成和铁离子依赖性过氧化脂质自由基的产生
第1种发生过程是由含PUFA的脂质暴露于氧化应激(活性氧ROS)时产生脂质自由基(L.;Lipid radical)开始。脂质自由基容易被氧化并转化为过氧化脂质自由基(LOO・; Lipid peroxyl radical),诱导自由基连锁反应。在第2种发生过程中,含PUFA的脂质被过氧化催化酶lipoxygenase转化为过氧化脂质(LOOH),并在存在大量的铁离子Fe2+ 时会诱导产生过氧化脂质自由基(LOO・)。过氧化脂质自由基与其他脂质反应,诱导自由基连锁反应。
两种过程所产生的过氧化脂质自由基(LOO・)都会在与其他脂质发生自由基反应并扩大自由基连锁反应,同时产生各种过氧化脂质(LOOH)。该自由基连锁反应直至被抗氧化剂聚合前会持续进行,并生成各种脂质结构或醛,最终产生复数的反应活性醛,如acrolein、malondialdehyde(MDA)、4-hydroxy-2-nonenal (4-HNE)等。以这些下游活性物质为起因,会对ER应激、细胞毒性和诱导铁死亡等产生各种影响。
脂质自由基(以及过氧化脂质自由基)被认为是脂质过氧化反应中最重要的最上游因子,虽然其检测方法备受期待,但直到现在,也仅有电子自旋共振(ESR)法等需要特殊设备的方法。LipiRADICAL Green和OH-Pen是由九州大学大学院药学院研究院生命物理化学系的山田健一教授等人开发的、具有新型氮氧化物骨架的脂质自由基响应性荧光试剂(原著名称为NBD-Pen)和抑制剂,它们不与活性氧自由基反应,实现特异性响应脂质自由基。由于LipiRADICAL Green可通过荧光检测来观察/分析脂质自由基,因此可用作以脂质自由基为中心的脂质过氧化反应的新工具。OH-Pen是从LipiRADICAL中去除荧光基团NBD的化合物,与一般的自由基中和剂(TEMPO等)不同,对脂质自由基显示高选择性,可作为脂质过氧化反应的特异性抑制剂使用。
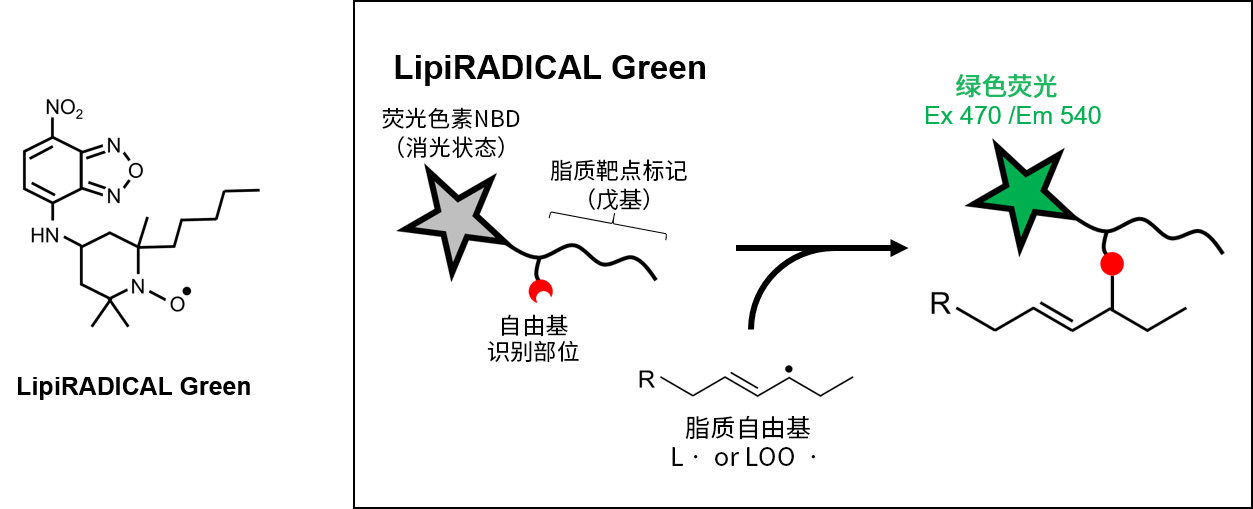
◆原理
LipiRADICAL Green是向稳定自由基化合物的氮氧化物衍生物中添加荧光色素NBD的化合物。由于氮氧化物对脂质自由基显示高特异性,所以导入了戊基。LipiRADICAL Green此时处于消光状态,但通过脂质自由基与自由基-自由基偶联形成共价键后,显示绿色荧光。通过观察该绿色荧光强度,可相对定量样品中脂质自由基含量。
OH-Pen是LipiRADICAL Green的NBD转化为羟基的化合物,显示相同的脂质自由基选择性以及拥有相同的脂质自由基中和作用。因此可将其用作脂质过氧化反应的抑制剂。
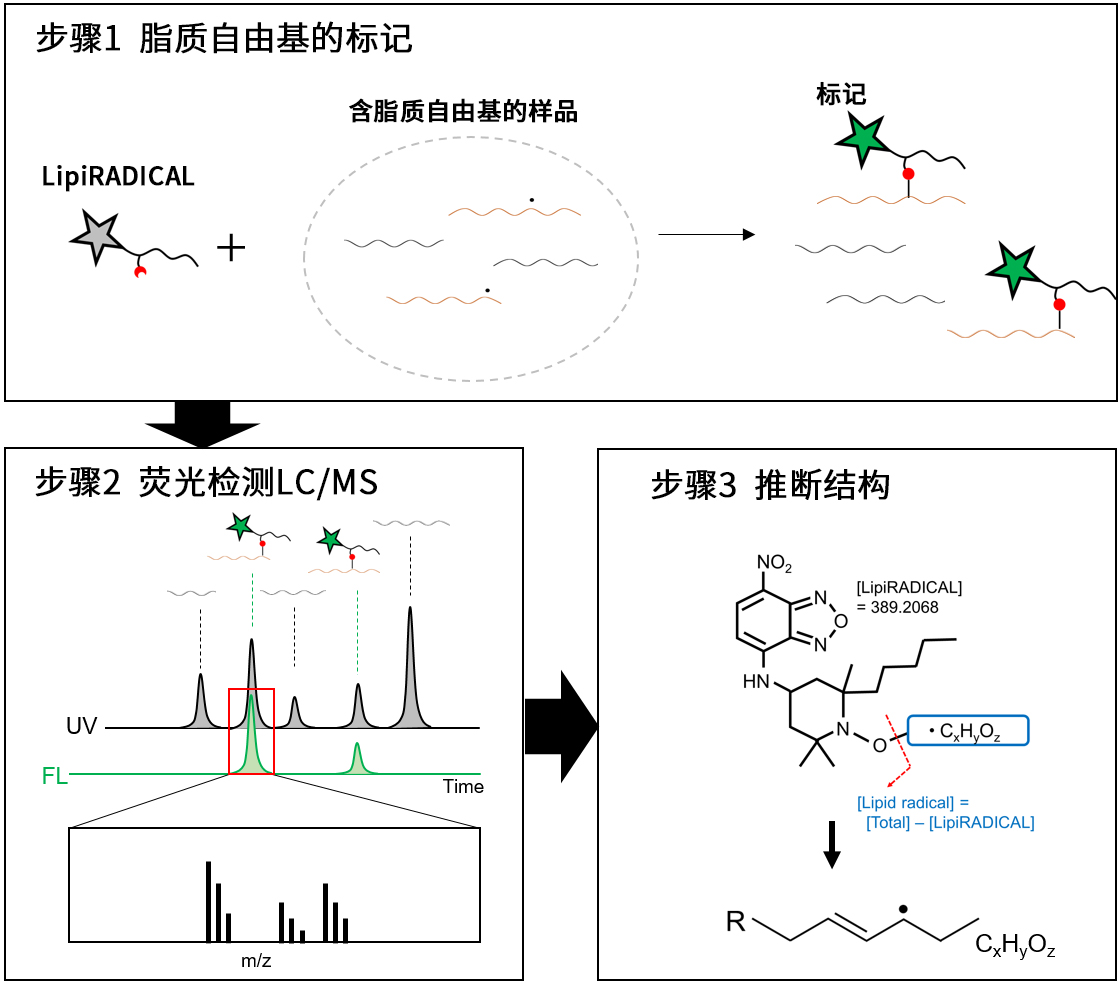
概述:对使用LipiRADICAL Green的脂质自由基进行全面分析
通过使用LipiRADICAL Green的荧光检测LC/MS-MS法可全面分析脂质自由基和过氧化脂质自由基。原著论文5中,已成功地从5种类型的PUFA中鉴定出共计132种脂质自由基。以下为流程概述,详细的实验方案、LC/MS-MS设置方法/分析方法,请参阅原著论文5。
■概述
|
步骤1 |
添加本试剂至含脂质的自由基样品中,并荧光标记脂质自由基。 ※ 若是动物实验,将本试剂施药于小鼠等动物并在动物体内荧光标记脂质自由基后,马上摘除器官并提取脂质组分。 |
|
步骤2 |
通过荧光检测LC/MS进行绿色荧光标记产物的质量分析。 |
|
步骤3 |
减去所得质量值中LipiRADICAL Green的分子量(理论值389.2068),并推断结构。 |
◆特点
LipiRADICAL Green
● 本试剂为消光状态,与脂质自由基/过氧化脂质自由基特异性反应,发出绿色荧光。
● 检测波长标准:激发470 nm /荧光520-600 nm(最大~540 nm)。
※ 详情请参阅数据。
● 对脂质自由基和过氧化脂质自由基具有特异性,在活性氧(H2O2、ClO–・、O2–・、・OH)中不发出荧光。
● 可通过荧光强度相对定量体外样品中的脂质自由基含量。
● 施药于动物个体后,可在组织水平上进行染色以及相对定量活体内的自由基含量。
※ 由于脂质自由基非常不稳定且会迅速分解,需要对实验方法和条件设置进行验证。详情请参阅原著论文1。
● 可用于评价任意化合物的脂质自由基诱导活性和抗氧化活性。
※ 详情请参阅原著论文4。
● 通过用荧光检测LC/MS可全面结构分析脂质自由基和过氧化脂质自由基。
※ 脂质自由基和过氧化脂质自由基的结构分析方法,请参考原著论文5。
OH-Pen
● 与脂质自由基和过氧化脂质自由基发生特异性反应以抑制自由基连锁反应,可用作脂质过氧化反应信号上游的抑制剂。
● 虽然是自由基化合物,但非常稳定,可体外施药至动物个体。
● 肝细胞癌的动物实验模型(diethylnitrosamine(DEN)给药模型)中显示,可抑制DEN诱发的脂质过氧化反应信号和组织损伤标志物。
注意:LipiRADICAL Green和OH-Pen的区别在于有无荧光基团(请参阅“原理”),对脂质自由基的反应性相同,同时使用时,可能会引起对
注意:脂质自由基的竞争性反应,因此需注意使用方法。
◆原著论文
1) Yamada Nat. Chem.Biol.,12,608~613(2016)Fluorescence probes to detect lipid-derived radicals.
2) Enoki et al., Chem.Commun.,53,10922~10925(2017)Lipid radicals cause light-induced retinal degeneration.
3) Ishida et al., Free Radical Biol.Med.,113,1487~493(2017)Detection and inhibition of lipid-derived radicals in low-density lipoprotein.
4) Mishima et al., J.Am. Soc.Nephrol.,31,280~296 (2020)Drug Repurposed as antiferroptosis agents suppress organ damage, including AKI, by functioning as lipid peroxyl radical scavengers.
5) Matsuoka et al.,Anal. Chem.,92,6993~7002(2020)Method for Structural Determination of Lipid-Derived Radicals.
◆参考数据
脂质自由基特异性荧光光谱
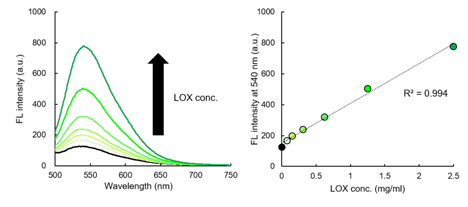
添加花生四烯酸(AA)和Lipoxygenase(LOX)至LipiRADICAL Green,观察470 nm的激发荧光。在未添加LOX的条件下,几乎没有观察到荧光,而添加LOX并产生脂质自由基后,可观察到500-650 nm范围内的荧光(最大540 nm附近)(左)。由此看出,荧光强度取决于添加的LOX浓度(右)。
自由基特异性
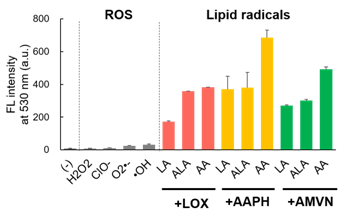
观察在以下条件中添加各试剂至LipiRADICAL Green的荧光强度(激发470 nm/荧光530 nm)。可观察到活性氧中的荧光几乎没有变化,而通过LOX酶或氧化诱导物质(AAPH和MeO-AMVN)的3种脂质产生的脂质自由基产生时的荧光强度有所上升。
H2O2, ClO– , KO2(O2–・),・OH :0.5 mM Lipids 0.5 mM (LA: linoleic acid, ALA: α-linoleic acid, AA: arachidonic acid ) + LOX 2.5 μg/mL or AAPH 10 mM or MeO-AMVN 50 μM
◆应用数据
活细胞成像
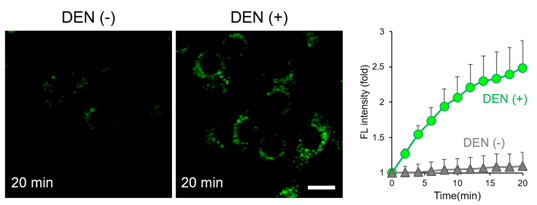
添加LipiRADICAL Green(1 μM)至Hepa1-6细胞培养20 min后,追加致癌性亚硝胺化合物DEN(30 mM)培养20 min,然后每隔2 min用激光共聚焦荧光显微镜进行活细胞成像(激发458 nm/荧光490-674 nm)。经DEN处理的细胞在添加试剂后,荧光强度立即随培养时长的增加而增加,这表明DEN是按顺序产生脂质自由基的。荧光显微镜图像为添加试剂后20 min内的数据。
体外检测LDL来源的脂质自由基
用氧化诱导物质Hemin或AAPH处理纯化的低密度脂蛋白LDL(20 μg protein/mL),添加LipiRADICAL Green(10 μM)并观察1 h内的荧光强度(激发470 nm/荧光530 nm),可检测到Hemin、AAPH随时间推移和试剂浓度依赖性荧光强度的增加,出现了不同的增加趋势。

脂质自由基结构分析
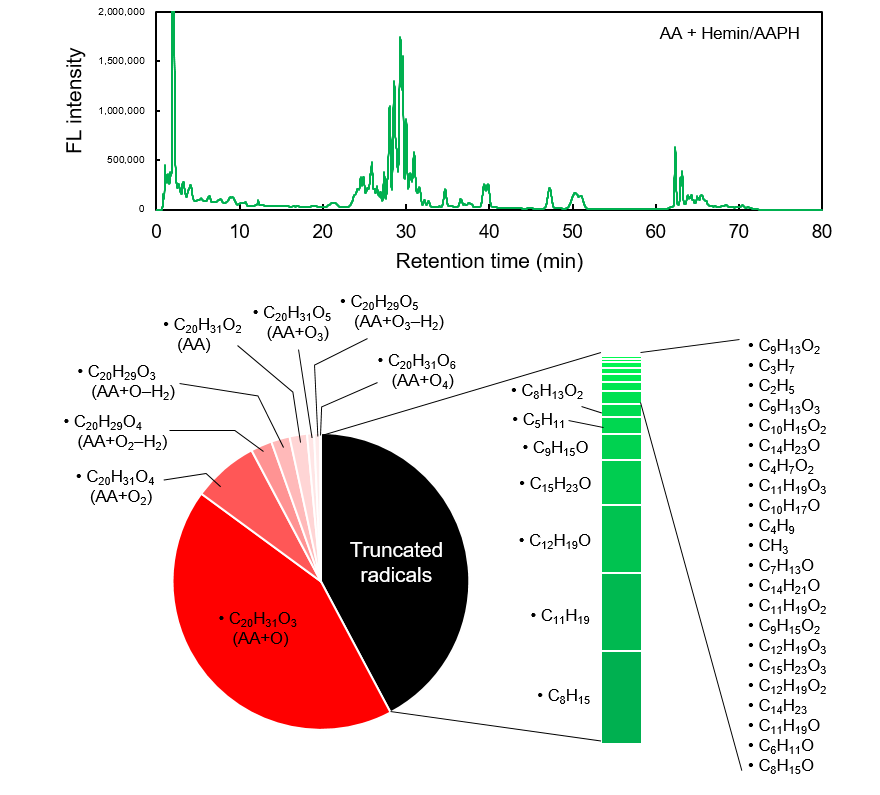
1)评价由氧化诱导剂(AAPH + Hemin)产生的自由基
体外添加LOX(10 μg/mL)和氧化诱导物质AAPH+Hemin(10 μM)至花生四烯酸(AA)中,诱导脂质自由基后添加LipiRADICAL Green并进行检测反应。之后通过Bligh&Dyer法纯化脂质成分,并用荧光LC/MS-MS对AA产生的自由基进行全面分析。
上图:荧光LC色谱(激发470 nm/荧光530 nm)。检测出多个峰,对各个峰进行MS-MS分析。
下图:用MS-MS分析比较经鉴定的各种脂质自由基生成量(注:用各自由基种类的LC峰面积的相对定量)。鉴定出8种类型的AA过氧化脂质自由基(圆图中的红线),此外还鉴定了由AA裂解产生的29种脂质自由基(条形图、绿线)。
* 有关详细的实验方案和分析方法,请参阅原著论文5。
2)DEN诱导时内源性产生的脂质自由基检测
向小鼠施以致癌性亚硝胺化合物DEN,分别在1 h、4 h、24 h后进行麻醉,向腹腔内施以LipiRADICAL Green,之后切除肝脏并压碎,用Bligh&Dyer法制备脂质提取液。并用荧光LC/ MS对各提取物进行各脂质自由基的鉴定以及相对定量。另外,NBD-Pen给药前15 min先施以脂质自由基抑制剂OH-Pen。可观察到左图所示的荧光LC色谱图,用MS/MS分析鉴定出共计11种类型的脂质自由基。随时间观察各脂质自由基种类(右图为C5H11的检测结果),可观察到DEN给药4 h后质谱峰面积大幅增加,而24 h后减少。LipiRADICAL Green给药前,经OH-Pen处理的小鼠脂质自由基被明显抑制。
* 有关详细的实验方案和分析方法,请参阅原著论文5。

3)使用本试剂进行体外鉴定脂质自由基
使用本试剂从5种PUFA【亚油酸(LA),α-亚麻酸(ALA),花生四烯酸(AA),二十二碳六烯酸(DHA),二十碳五烯酸酯(EPA)】中经LOX、AAPH以及Hemin处理后鉴定的脂质自由基列表如下(摘自原著论文5)。

通过OH-Pen抑制亚硝胺诱导肝细胞癌
向大鼠施以致癌性亚硝胺化合物DEN后,1 h后再施以OH-Pen。分别切除慢性模型12周后和急性模型24 h后的大鼠肝脏。
上图:慢性模型的肝癌。DEN给药使恶性肿瘤亢进,而施以OH-Pen可明显抑制该反应。
中图:急性模型LPO代谢产物的定量评价。发现OH-Pen抑制了DEN引起的MDA、4-HNE及Acrolein这三种LPO下游产物的增加。
下图:急性模型组织损伤标记物的定量评价。发现OH-Pen抑制了DEN引起的8-OHdG、ALT及细胞凋亡量的增加。
这些结果显示,DEN引起LPO亢进并产生脂质自由基后会诱导各种毒性信号,但OH-Pen可通过抑制初期脂质自由基连锁反应来抑制癌变。

◆常见问题FAQ
问:ES-Buffer可以与非FUJIFILM Wako生产的鲎试剂一起使用吗?
答:是的。该缓冲液不限所搭配的鲎试剂品牌,可与其他品牌非特异性鲎试剂配合使用,阻断(1→3)-β-D-葡聚糖与
鲎试剂反应,从而将鲎试剂转化为内毒素特异性试剂。
问:如何使用ES-Buffer?
答:只需按照包装中的鲎试剂说明书,用ES-Buffer代替LRW(鲎试剂用水)来溶解和制备鲎试剂,即可制备内毒素
特异性鲎试剂。之后按照鲎试剂制造商的说明书进行操作即可。