上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 操作流程简便
● 与LC3结果高度一致
● 可以动态观察细胞自噬


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Mitophagy Detection Kit 线粒体自噬检测
NO.3. Calcein-AM/PI Double Staining Kit 活死细胞双染
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
产品概述
DAPGreen是一种小分子荧光染料,可以用来检测自噬体及自噬溶酶体。由于其特殊的结构,在自噬体形成双
层膜结构时染料可以进入其中,并在疏水环境中产生荧光。DAPGreen具有很好的细胞透膜性,通过荧光显微
镜可进行活细胞荧光成像,也可使用流式细胞仪进行定量检测。
原理
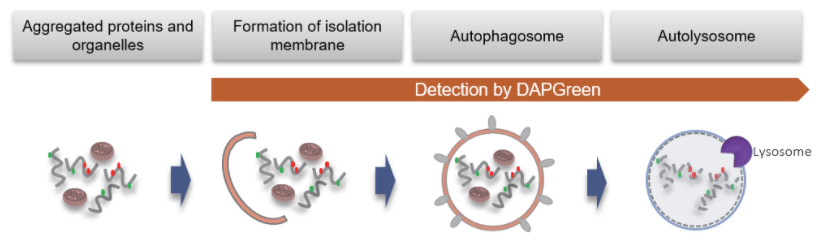
当形成自噬体膜时,DAPGreen可以掺入其中,并在脂溶性环境中产生荧光。
DAPGreen的检测结果与细胞自噬标志物LC3的结果有很高的相关性。
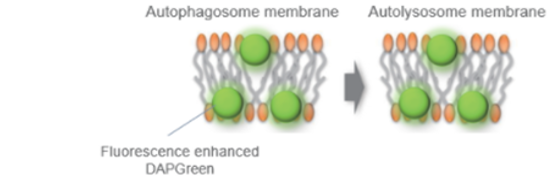
试剂概要
DAPGreen不仅可以用荧光显微镜检测,还可以使用流式细胞仪进行检测。
同时也实现了用荧光酶标仪进行检测,您可以根据自己的实验条件,使用不同的仪器进行检测。
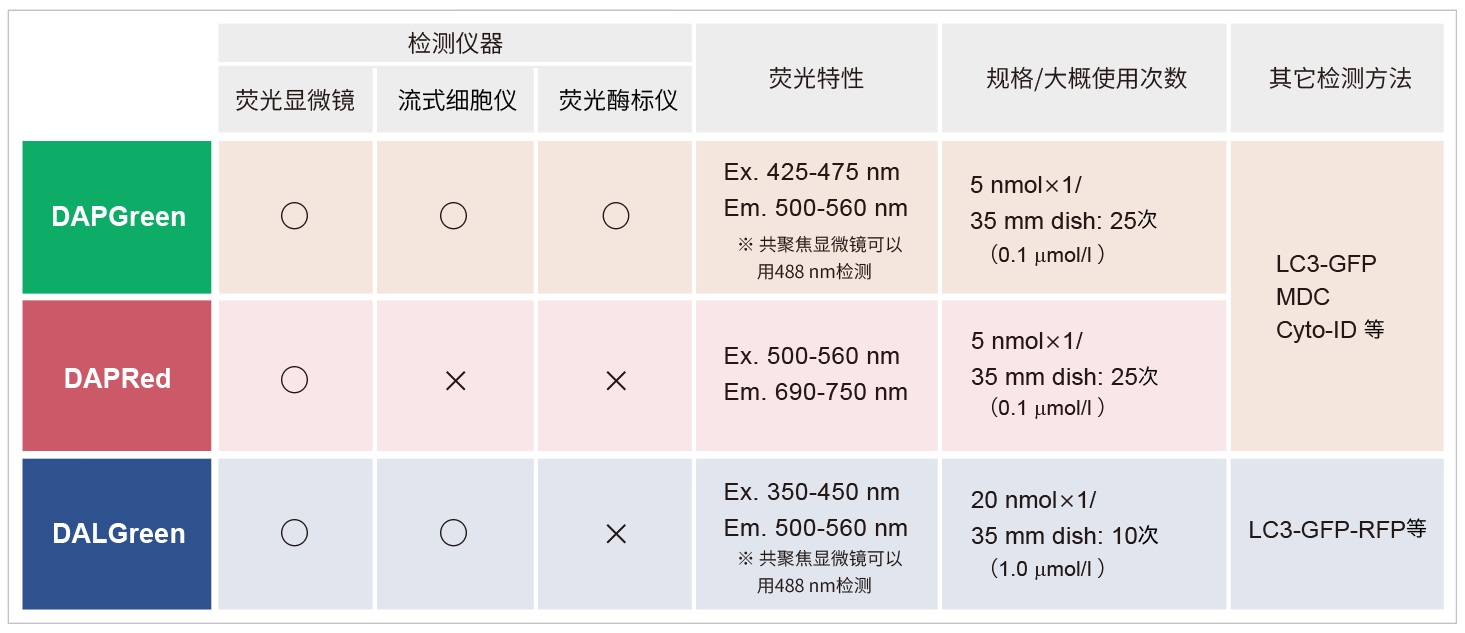 *DAPGreen和DALGreen不能共染
*DAPGreen和DALGreen不能共染
操作简便
操作流程只有一步-加入试剂
只需向准备好的细胞加入DAPGreen染料,即可方便快捷的进行荧光检测。
实验例
与LC3高度相关
与自噬标准物LC3的细胞共染实验结果的比较。
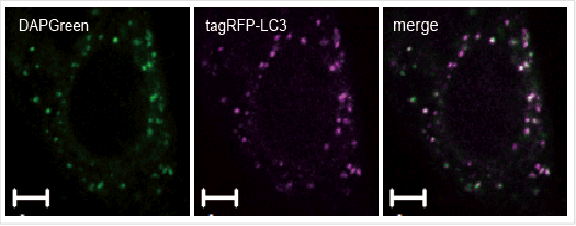
检测条件:DAPGreen:Ex. 488 nm / Em. 500-563 nm
比例尺:10 μm
将DAPGreen加入已表达tagRFP-LC3的Hela细胞中,用雷帕霉素(Rapamycin)诱导自噬4 h后,用共聚焦显微镜观察DAPGreen和RFP的荧光成像。结果DAPGreen与tagRFP-LC3的染色部位高度一致。
与Lamp-1共染 
对已经表达Lamp1-tagRFP的MEF细胞进行DAPGreen共染实验。结果显示,DAPGreen的染色部位与溶酶体膜蛋白标记物Lamp 1的位置高度一致。(比例尺:10 μm)
实验的详细情况请参考如下论文:
“Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.
流式细胞仪的定量分析
自噬诱导后,通过流式细胞仪检测DAPGreen的荧光。
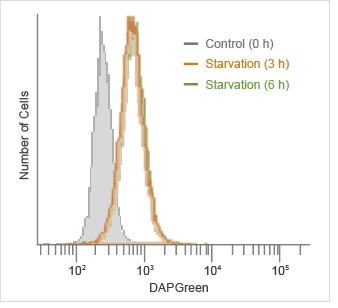
检测条件:
检测波长:Ex. 488 nm / Em. 500-560 nm
DAPGreen染色HeLa细胞后,在不含氨基酸的培养基中培养0、3和6 h,用流式细胞仪检测。结果,在饥饿诱导3 h后可以检测到更强的荧光信号。
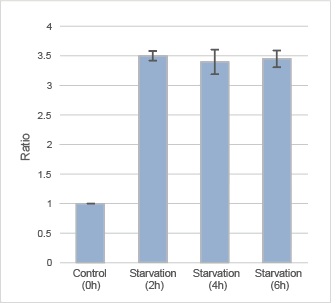
荧光酶标仪的定量检测
用荧光酶标仪检测自噬诱导后DAPGreen的荧光。
检测条件
检测波长:Ex. 450 nm / Em. 535 nm
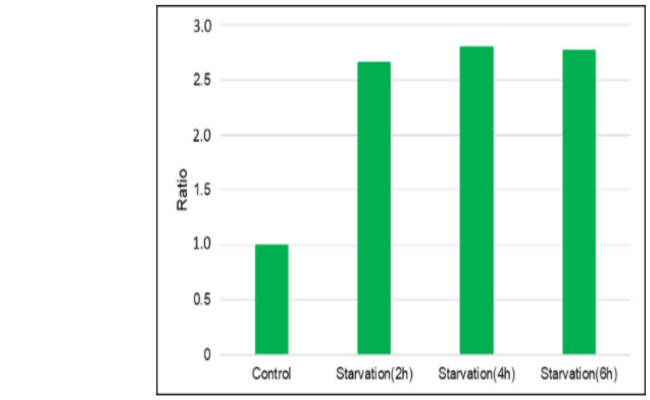
DAPGreen染色HeLa细胞后,在不含氨基酸的培养基中分别培养0、2、4、6 h,用荧光酶标仪检测。结果饥饿诱导2 h检测荧光,饥饿诱导组的荧光强度大约是对照组的3.5倍。
有关检测操作的详细信息,请参考FAQ“使用荧光酶标仪进行定量分析的检测条件是什么?”。
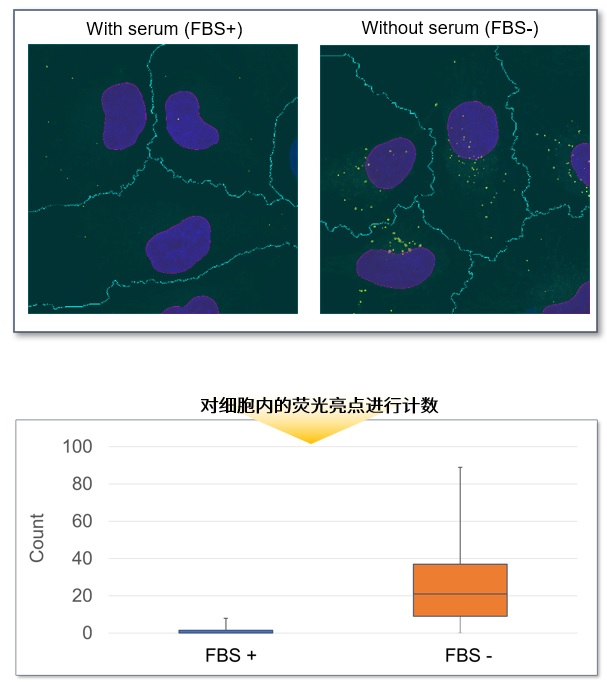
应用例:荧光显微镜的数值化
96孔板中接种HeLa细胞,并用DAPGreen染色后,分别更换含有血清和不含血清的培养基后继续培养。培养后分别通过视野内的平均荧光强度进行计算。结果发现,不含血清的培养基培养的细胞中DAPGreen的荧光强度更高。

<检测条件>
Ex:488 nm, Em: 500-550 nm
物镜: CFI Plan Apochromat VC 20x
拍摄模式: Resonant Scanner
XY分辨率:512×512
<使用装置>
荧光显微镜:Nikon 激光共聚焦显微镜A1R
分析软件:NIS-Elements
<实验步骤>
1. 将HeLa细胞播种于96孔板中并培养。
2. 去除培养基,用无血清培养基清洗1次。
3. 添加配置好的DAPGreen working solution ,37℃ 培养30 min。
4. 去除培养基,用无血清培养基清洗2次。
5. 诱导自噬的孔中加入无血清培养基,正常孔中加入正常培养基。37℃培养6小时(之后用4%PFA固定)。
6. 荧光显微镜观察。
按上述条件拍摄后,再用100倍物镜放大后拍摄,对细胞内的DAPGreen的荧光信号进行统计。结果显示,含有血清的培养基培养的细胞中平均每个细胞有1.5个信号,而不含血清的培养基培养的细胞中平均每个细胞有27个信号。
<检测条件>
Ex : 488 nm, Em : 500-550 nm
物镜: CFI Plan Apochromat TIRF 100xC Oil
拍摄模式: Galvano Scanner
XY分辨率:512×512
<使用装置>
荧光显微镜:Nikon 激光共聚焦显微镜A1R
分析软件:NIS-Elements
*本数据由DAPGreen的使用客户友情提供。
DAPGreen荧光光谱
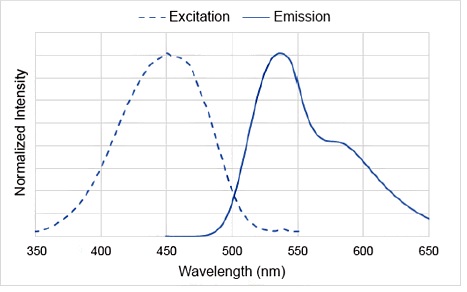
激发滤光片:425-475 nm
荧光滤光片:500-560 nm
常见问题Q&A
| Q1: DAP Green working solution的稳定性如何? |
| A1:无法长期保存,需要现配现用 |
| Q2: DMSO stocking solution 的稳定性如何? |
| A2:配制后请于-20℃保存,一个月内可保持稳定。另外建议根据用量分装保存。 |
| Q3: 推荐使用的滤光片? |
| A3:激发波长:425-475 nm
发射波长:500-560 nm 利用激光共聚焦显微镜的488 nm激发波长也可以检测,请参考我们公司网站产品页面的实验例。 |
| Q4: 在进行延时成像时有什么要注意的地方吗? |
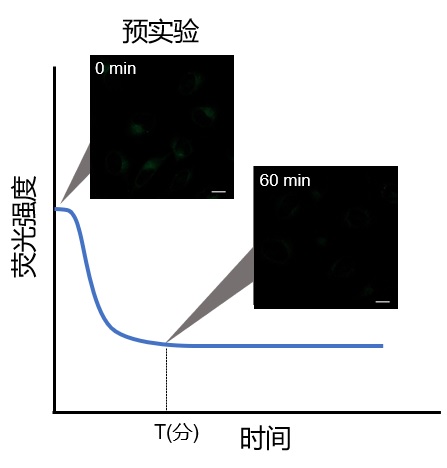
| 4:为了确定最佳实验条件,请先进行预实验。
由于试剂的特性,刚刚染色后有荧光值升高的趋势,因此请参照以下步骤进行预实验和延时成像。
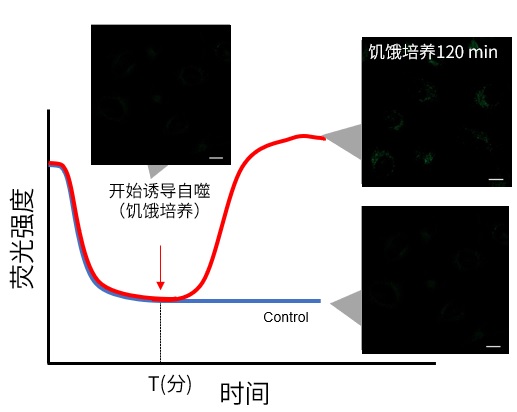
1. 预实验 使用对照细胞(不诱导自噬的细胞)。 根据说明书的步骤用 Working Soluiton染色后,用培养基洗涤2次。 加入正常培养基后,观察荧光随时间的变化。 如下图所示,染色后的细胞在荧光强度阶段性降低之后,确认荧光强度变化趋于稳定的时间段(图中的T)。 ※条件可能因细胞种类而异。 (参考) HeLa细胞染色约60分钟后,荧光会趋于稳定(DAPGreen)。
2. 延时染色成像 – 细胞用Working Solution染色后,在培养基中37℃培养。 ※培养时间为预实验中摸索出的染色时间。验中摸索出的染色时间。 ※染色后不要立刻进行自噬诱导。 -培养后进行自噬诱导并开始延时染色成像。 (参考) 用DAPGreen对HeLa细胞进行染色,在正常的培养基中培养60分钟(预实验中摸索的时间)后,进行自噬诱导。 |
| Q5: 如何确定细胞自噬探针DAPGreen的最佳浓度? |
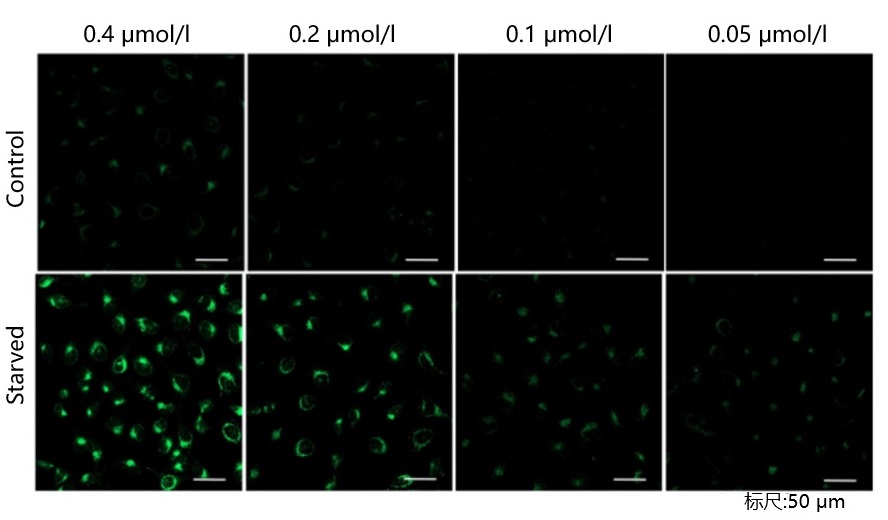
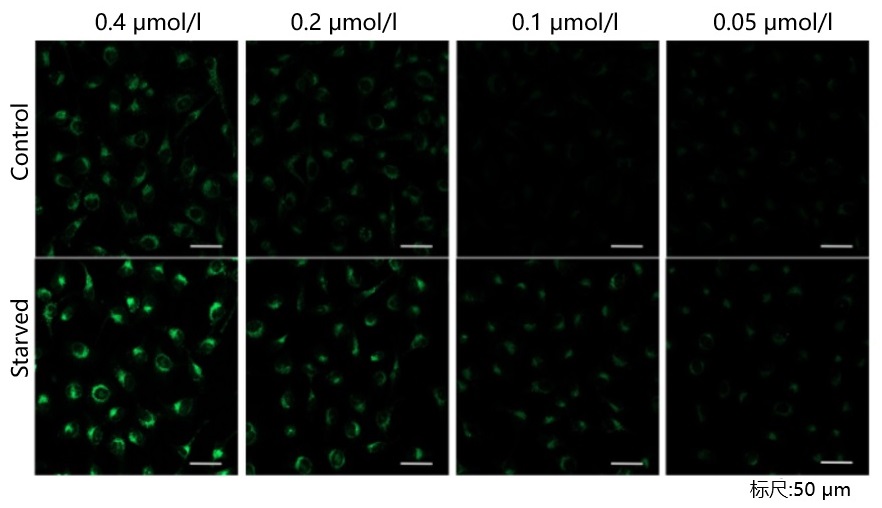
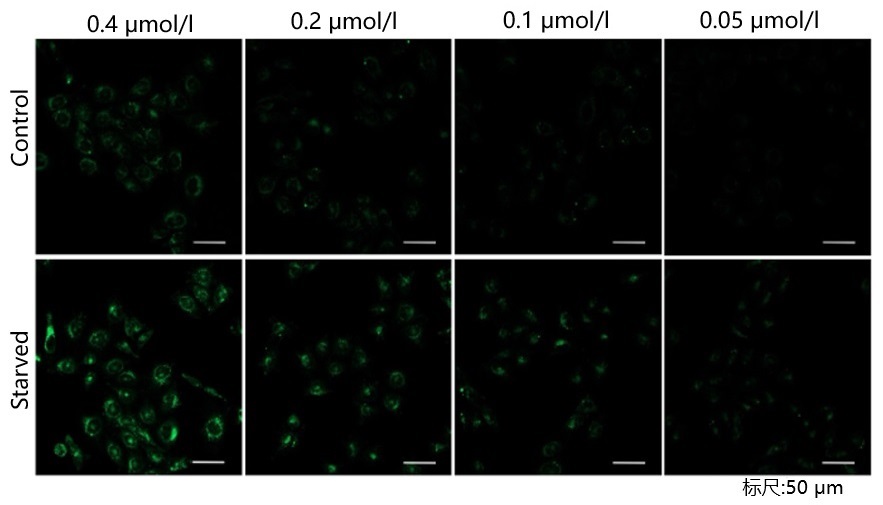
| A5: 由于本试剂的特性,如果试剂的浓度太高或太低都会导致诱导自噬的样品组与未诱导自噬的对照组之间的差别不明显。建议参考以下信息摸索试剂的最佳浓度:
探针的最佳浓度根据细胞的种类而不尽相同。以DAPGreen为例可以考虑从最低浓度(可以以0.05 μmol/l作为参考)开始分别多个梯度至摸索至最高浓度(可以以0.4 μmol/l作为参考)的步骤进行摸索。 参考例: 我们公司对HeLa, HepG2, CHO细胞的最佳浓度进行了摸索。DAPGreen以下列浓度进行染色,并在无氨基酸的培养基中培养以诱导自噬。下表中红色字体的浓度可明显观察到实验组与空白组的差异。 [HeLa细胞]
<检测条件>放大倍率:20倍; 激发波长:Ex:488 nm;发射波长:Em:500-563 nm [HepG2细胞]
<检测条件>放大倍率:20倍; 激发波长:Ex:488 nm;发射波长:Em:500-563 nm [CHO细胞]
<检测条件>放大倍率:20倍; 激发波长:Ex:488 nm;发射波长:Em:500-563 nm |
| 细胞种类 | DAPGreen浓度 | |||
| Hela | 0.4 μmol/l | 0.2 μmol/l | 0.1 μmol/l | 0.05 μmol/l |
| HepG2 | 0.4 μmol/l | 0.2 μmol/l | 0.1 μmol/l | 0.05 μmol/l |
| CHO | 0.4 μmol/l | 0.2 μmol/l | 0.1 μmol/l | 0.05 μmol/l |
| Q6: 使用荧光酶标仪进行定量分析的检测条件是什么? |
| A6:以下是使用HeLa细胞进行检测的实验例。
将DAPGreen染色的HeLa细胞在不含氨基酸的培养基中分别培养0、2、4、6 h,用荧光酶标仪检测。 <操作> 1)将细胞接种在透明底的黑板上(HeLa细胞,1.6×104 cells/孔,100 µl/孔) 2)在37°C,5% CO2培养箱过夜培养 3)去除上清液后,在培养基中加入100 µl配制好的Working Solution(DAPGreen:0.1 µmo/l)。 4)在37°C,5% CO2培养箱培养30 min 5)用100 µl培养基清洗细胞2次 6)加入100 µl饥饿培养基(Waco,Code:048-33575) 7)在37°C下培养各时间点 8)用荧光酶标仪(TECAN,Infinite Pro M200)检测(Ex/Em = 450 nm/530 nm) (0 h对照组用HBSS代替检测) <检测条件>波长:Ex. 450 nm/Em. 535 nm 饥饿诱导2 h检测荧光,确认到饥饿诱导组的荧光强度大约是对照组的2.5倍。 |
| Q7: 自噬有哪些途径?DAPGreen可以检测到哪些状态? |
| A7:众所周知,自噬根据其分子机制可以分为两种:一种是依赖于ATG5的传统自噬(LC3发生变化),另一种则是非依赖于ATG的选择性自噬(LC3形式的转化并未发生)。
当形成自噬体膜时,DAPGreen可以掺入其中,并在脂溶性环境中产生荧光。因此DAPGreen可以检测自噬体的状态。 *参考资料:发现新的自噬机制Shigeomi Shimizu https://www.dojindo.co.jp/letterj/160/review/01.html 文献链接:http://dx.doi.org/10.14348/molcells.2018.2215 ▶对于首次检测的细胞类型和实验条件,请参考FAQ[如何确定细胞自噬探针DAPGreen的最佳浓度]。 |
参考文献
| No. | 检测样品 | 检测仪器 | 引用(含链接) |
| 1) | 细胞 (HeLa, MEF) |
荧光显微镜 | H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, “Small fluorescent molecules for monitoring autophagic flux.”, FEBS Letters., 2018, 592, (4), 559–567. |
| 2) | 细胞 (HepG2; Huh-7) |
荧光显微镜;流式细胞仪 | L. Hu, T. Zhang, D. Liu, G. Guan, J. Huang, P. Proksch, X. Chen and W. Lin, “Notoamide-type alkaloid induced apoptosis and autophagy via a P38/JNK signaling pathway in hepatocellular carcinoma cells”, RSC Adv., 2019, 9, 19855. |
| 3) | 细胞 (HepG2) |
荧光显微镜 | Q. Chu, S. Zhang, M. Chen, W. Han, R. Jia, W. Chen and X. Zheng, “Cherry Anthocyanins Regulate NAFLD by Promoting Autophagy Pathway”, Oxid Med Cell Longev., 2019,DOI:10.1155/2019/4825949. |
| 4) | 细胞 (HLMVEC) |
荧光显微镜 | Q. Chu, S. Zhang, M. Chen, W. Han, R. Jia, W. Chen and X. Zheng, “Cherry Anthocyanins Regulate NAFLD by Promoting Autophagy Pathway”, Oxid Med Cell Longev., 2019,DOI:10.1155/2019/4825949. |
| 5) | 细胞 (HeLa) |
荧光显微镜 | F. Hongbao,Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie , “De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.”, ACS Nano, 2019, 13, (12), 1446. |
| 6) | 细胞 (HeLa; A375) |
流式细胞仪 | B. Yang, L. Ding, Y. Chen and J. Shi, “Augmenting Tumor-Starvation Therapy by Cancer Cell Autophagy Inhibition”, Adv. Sci., 2020,DOI:10.1002/advs.201902847. |
| 7) | 细胞 (PC12) |
荧光显微镜(超分辨率) | Y. Tan, L. Yin, Z. Sun, S. Shao, W. Chen, X. Man,Y. Du and Y. Chen, “Astragalus polysaccharide exerts anti-Parkinson via activating the PI3K/AKT/mTOR pathway to increase cellular autophagy level in vitro.”, Int. J. Biol. Macromol., 2020, DOI:10.1016/j.ijbiomac.2020.02.282. |
| 8) | 细胞 (Wild type Hepa 1-6) |
荧光显微镜
(用ImageJ软件数值化) |
J. Kim, W.Y.Chee, N. Yabuta, K. Kajiwara, S. Nada and M. Okada, “Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts”, Biochem. Biophys. Res. Commun., 2020, 22, DOI:10.1016/j.bbrc.2020.05.083. |
| 9) | 细胞 (小鼠皮肤成纤维细胞) |
流式细胞仪 | J. Kim, W.Y.Chee, N. Yabuta, K. Kajiwara, S. Nada and M. Okada, “Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts”, Biochem. Biophys. Res. Commun., 2020, 22, DOI:10.1016/j.bbrc.2020.05.083. |
| 10) | 细胞 (HeLa) |
荧光显微镜(超分辨率) | Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao, “Prefused lysosomes cluster on autophagosomes regulated by VAMP8”,2021, doi:10.1038/s41419-021-04243-0. |
关联产品




实验工具|稀释计算器|摩尔浓度计算器