向小鼠T细胞中导入siRNA
通过敲降CDK8/19表达诱导Foxp3
![]()
为了抑制有害免疫反应(例如自身免疫性疾病和变态反应),其中一种方法是将介导疾病的T细胞转化为免疫抑制性调节性T细胞(Treg)。在这里,我们显示对细胞周期蛋白依赖性激酶8(CDK8)和CDK19的化学抑制,或CDK8或CDK19基因的敲降/敲降,能够在抗原刺激下诱导Foxp3(控制Treg细胞功能的关键转录因子)效应子/记忆以及未成熟的CD4+ 和CD8+ T细胞。诱导与STAT5激活相关,独立于TGF-β的作用,不受炎症细胞因子的影响。结果表明,CDK8/19在生理上抑制活化的常规T细胞中的Foxp3表达,并且其药理抑制作用使得抗原特异性效应子/记忆T细胞能够转化为Foxp3+Treg细胞,有望用于治疗各种免疫疾病。
传统的脂质体转染方法和电穿孔转染方法不能有效地对免疫细胞进行转染,本研究采用了日本石原产业的GenomONE® 仙台病毒包膜转染技术,通过将siRNA包装到仙台病毒包膜(HVJ-E)中,与靶细胞接触后,通过F蛋白介导膜融合,将siRNA导入到T细胞内部,轻松实现免疫细胞的高效表达敲降。
数据提供:大阪大学 免疫学前沿研究中心 实验免疫学领域 三上统久 老师
相关文献:Sci. Immunol, 4, eaaw2707 (2019).
◆结果

图1 小鼠T细胞中CDK8、CDK19的敲降


图2 CDK8/19敲降后Foxp3的表达
通过使用GenomONE–Si 进行转染,抑制了小鼠T细胞中CDK8、CDK19的基因表达(图1)。另外,在敲降了CDK8/19的状态下进行Treg诱导实验的结果表明,抑制CDK8/19的表达能够促进Treg的分化(图2)。
◆结论
在不使用重组病毒的情况下,通过GenomONE–Si成功将小鼠原代T细胞导入了siRNA。
◆实验方法
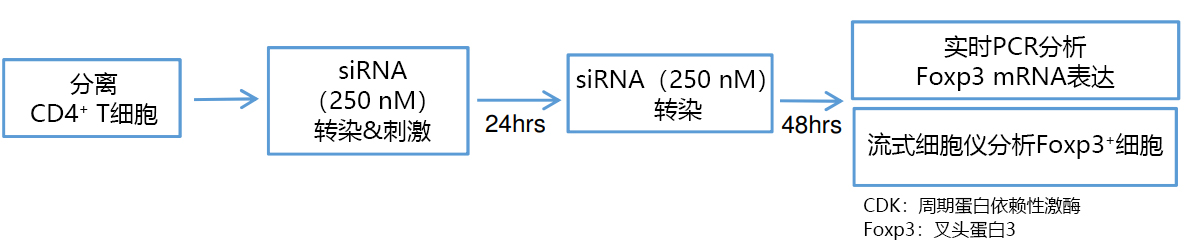
1. 表达Foxp3-GFP报告基因的小鼠的淋巴结中分离T细胞;
2. 使用GenomONE-Si转染分离细胞中的CDK8或CDK19的特异性siRNA(250 nM);
3. 存在IL-2(50 U/mL)、TGF-β(2 ng/mL)的情况下使用小鼠T细胞激活磁珠刺激T细胞
3. (2×104/well : 96 well plate);
4. 培养24 h后,按照步骤2. 再次转染siRNA;
5. 步骤4. 培养48 h后,通过流式细胞仪以及实时PCR检测CD4阳性细胞中的Foxp3阳性细胞、CDK8/19 mRNA表达量。
◆HVJ-E载体的制备方法
按照GenomONE–Si 使用说明书操作方案(1)进行
【细胞】:Foxp3-GFP报告小鼠的淋巴结中分离的T细胞
【培养条件】:2×104 cells/well/100 μL,RPMI-1640,10% FBS,penicillin G (60 μg/mL),
【培养条件】:streptomycin (100 μg/mL),0.1 mM 2-ME
【培养板】:96 well 培养板
【siRNA】:CDK8 siRNA,CDK19 siRNA,Negative control siRNA (Thermo Fisher Scientific )
【转染】:GenomONE–Si(石原产业)
|
步骤 |
流程 |
试剂量 |
|
① |
使用微型试管提取HVJ-E悬浮液中 |
HVJ-E悬浮液:2.5 μL |
|
② |
添加·混合Reagent D(轻敲混匀) |
Reagent D:0.5 μL |
|
③ |
添加·混合siRNA溶液(轻敲混匀)(50 μM) |
siRNA溶液:10 μL |
|
④ |
添加·混合Reagent E(轻敲混匀) |
Reagent E:5 μL |
|
⑤ |
将步骤④中制备的HVJ-E载体悬浮液添加到孔中的细胞培养液中,在37°C、5% CO2下培养。 |
HVJ-E载体悬浮液(①+②+③+④): 2 μL/well |
在冰上进行①~④的操作。
CDK8/CDK19 siRNA转染时,按照上述操作方案分别制备siRNA,并以2 μL/well(总计:4 μL/well)加入至孔中。
