用“CellSaic”技术进行MSC细胞移植

本文是将Current Stem Cell Research & Therapy, 2019, 14, 52-56发布的原文经出版社的允许由原作者亲自译成日语的文章。
原作者:FUJIFILM Group 生命科学&技术开发中心 中村健太郎
在干细胞的治疗领域中,由于其功能的多样性,对间充质干细胞(MSCs)相关的研究正在积极进行。一方面,细胞移植的形态从单一细胞悬液的给药方式向2D,3D研究方向发展。其中,我们报告了一种细胞聚集体形态与xeno-free重组支架相结合的被称为CellSaic的细胞治疗平台。CellSaic是按照马赛克状将细胞和花瓣状片装配起来的细胞移植形态,以避免细胞聚集体中心坏死。可避免中心坏死的这一点,是其他的3D培养系统无法比拟的优点。本文总结了CellSaic的基本性能、安全性试验结果以及其应用的研究结果。据报道,在IBD(炎症性肠病)、脑梗塞、骨/软骨、胰岛移植等应用领域中进行MSC移植,MSC CellSaic比起MSC细胞的单独给药更有效。在"One Health"的理念下,可以期待本技术运用于伴侣动物治疗与人体治疗。
1. 介绍
自Langer和Vacanti 1993年提倡组织工程学这一理念以来,蛋白支架在细胞移植和再生医疗中的应用被长期研
究。1)以前动物明胶和动物来源胶原蛋白等天然来源的支架已被应用于研究,有报告称支架的存在可以提高细胞的机能。2)-5)
然而,以21世纪初发生的BSE(Bovine Spongiform Encephalopathy)问题为契机,医药品和医疗器械的原材料中,不含动物来源成分、无异源这一概念被重视起来,支架的材料也开始追求无异源。6)-8)
另一方面,细胞治疗研究以细胞悬液的给药研究为中心开始发展。其中,由于MSC(mesenchymal stem cell)功能多样,被广泛用于临床应用。9)-10)适用对象覆盖了IBD11),整容领域12)-13),GVHD(移植物抗宿主病)14)-16),自身免疫性疾病9),脑梗塞17)-18),心肌梗塞19),20)等多个领域。与近年"One Health"的概念相结合,治疗对象也从人体治疗扩大到伴侣动物治疗。22),23)
细胞移植的形态从单一细胞悬液的给药方式向细胞2D、3D研究不断发展。24)- 26) 特别是近年报告了许多被称为3D球体状的细胞聚集体,26)- 28)我们报告了一种细胞聚集体形态与无异源重组支架相结合的、称为CellSaic的细胞治疗平台。29), 30) 支架使用了重组肽片(RCP)petaloid μ-piece,细胞主要使用MSC,两者所获得的马赛克状的细胞聚集体称为CellSaic(cell- and scaffold-forming mosaic)29)-31)
本文主要就CellSaic的特点和关于将来MSC移植的应用进行了相关的介绍。
2. CELLSAIC的基本特征
2.1. 支架的形状:RCP petaloid μ-piece
我们着眼于细胞成为聚集体时发挥的功能,同时以形成聚集体导致的中心坏死为课题,希望通过组成最小限度的支架来解决问题。(Fig.1)29),30)

Fig. (1). The design concept of CellSaic.
首先,为了形成最小限度的支架形状,我们尝试了球型和简单的形状。然而,这种支架形状,虽然有着为细胞提供粘着表面的效果,但是由于营养不足无法防止中心坏死。因此,我们对支架的设计进行了修改,既要满足细胞粘附在一起时的大小以及形状,还要在细胞聚集起来时,留出营养物质以及代谢物可以通过的间隙。结果,我们发现就和以往的报告一样,大小为50-100 μm左右,并且花瓣状的RCP petaloid μ-piece支架构造是更合适的。29),32)
通过设计成petaloid形状使细胞接触表面积增大的同时,由于形状的复杂性为细胞聚集体(CellSaic)提供了间隙,无论是in vitro检测还是in vivo检测移植细胞的生存率都提高了。支架的形状也可以通过表现复杂性的参数(振实密度以及制剂断面的√(表面积)÷(周长)Tapped density and The boundary length to square root of the area ratio)的数值的规定。29),32)
2.2. 提高移植细胞存活率,提高血管导入率以及细胞因子释放的变化
据报告,CellSaic的基本特征有 i). 提高移植细胞存活率,ii). 提高血管导入率,iii). 细胞因子释放的变化。
i). 关于提高移植细胞存活率的机制,在于支架的存在有效地抑制了细胞失巢凋亡,以及避免了细胞聚集体中的中心坏
i). 死。尤其是后者,支架的形状以及有无支架都会形成显著的差异。29)
ii). 关于提高血管导入率的机制,原因主要有两点,第一,因为是在graft中有间隙结构;第二,由于细胞和
ii). μ-piece可以重新装配,宿主来源的血管系细胞容易迁移。实际上,在NOD SCID小鼠的实验中与MSC球体相
ii). 比,MSC CellSaic导入的血管明显较多。
iii). 关于细胞因子释放的变化,虽然目前为止还没有充分进行验证,但是存在细胞因子释放量发生差异的情况,
iii). 这点与只有细胞的时候不同。其中一例就是由于MSC,TSG-6的释放量增大。该报告中,当MSC是CellSaic
iii). 的形态时,可以确认抗炎症细胞因子之一的TSG-6被大量释放。33),34)
2.3. MSC CellSaic的安全性试验
据报导,为了确认CellSaic的安全性,使用了狗脂肪来源干细胞(c ADSC)相关的cADSC CellSaic,使用了NOG小鼠进行致瘤性试验以及一般毒性试验。33)
遵循"One Health"的理念,假定伴侣动物疗法中的临床研究与人体治疗产品开发相关,评价了狗ADSC CellSaic的安全性。结果,没有观察到致瘤性,一般毒性的结果也没有检测出显著的毒性。33)
具体来说,作为一般毒性以及致瘤性试验,进行了cADSC CellSaic组(每只小鼠一只107 cells的cADSC和1.04 mg的μ-piece)和对照组(生理盐水),对照组(培养基)的比较试验。在实施中我们参考了WHO指南,每组使用12只雄性和12只雌性的NOG小鼠。35) 致瘤性试验的第11天未观察到皮下结节,并且在病理学的评价中,第4周和第8周也没有发现细胞分裂的画像。在一般毒性试验中,各组之间的血液生化学检测、血液学检测、器官重量、摄食量都没有显著的差异。在器官的病理学的评价中,cADSC CellSaic组在第4周和第8周都没有发现异常。33)
3. CELLSAIC的应用
3.1. MSC CellSaic相关的细胞治疗研究
在MSC CellSaic相关的疾病治疗研究中,有MSC CellSaic应用于IBD (炎症性肠病)、脑梗塞、关节的骨软骨再生、胰岛移植的报告。这些应用的研究中,与单独使用MSC进行比较,使用MSC CellSaic 可以提高各种症状的改善效果。
在DSS模式小鼠的炎性肠病的适用研讨中,单独使用MSC而症状没有得到充分改善的模式小鼠,通过给药MSC CellSaic,症状得到了改善。33) 具体地说就是在肠炎DSS模式小鼠中,与单独使用MSC的比较试验里,MSC CellSaic显示了更显著的体重恢复和结肠长度的改善。
作为溃疡、浮肿和炎性细胞浸润的病理学评价结果,histrogical score得到了改善,并且溃疡和浮肿得到了抑
制。33)
此外,还提及到了提高MSC的体内残存以及提高抗炎症细胞因子的释放。在脑梗塞小鼠模型中,与单独使用MSC的局部给药相比,MSC CellSaic的局部给药有助于改善运动机能。36),37)
另外,Naritomi及其研究人员们还报告了与单独使用MSC相比,在向软骨分化方面,MSC CellSaic显著提高了软骨分化以及增加了软骨基质的产生。38)使用兔子的骨软骨缺损样本进行试验的结果,与单独使用MSC相比,MSC CellSaic更能促进骨软骨再生。39)
在向胰岛移植的MSC共移植的报告中也是通过活用CellSaic,提高了胰岛的存活以及糖尿病小鼠模型的血糖值控制效果。29)
以上都是在报告了MSC有效的疾病中,单独使用MSC和MSC CellSaic进行了比较试验的报告。
从这些报告中可以看出,CellSaic有可以增强MSC治疗效果的可能性。
3.2. 在胰腺癌模型中的使用
有报道称在药物研究中利用CellSaic,可以在制作模式动物时使用MSC CellSaic对其进行评估。在该报导中,制作胰腺癌的荷瘤模式动物时,在癌细胞移植时使用MSC CellSaic,结果在胰腺癌周边形成了丰富的间质组织。40)一方面,在仅移植癌细胞的时候,不能识别如此丰富的间质组织。拥有丰富间质组织的胰腺癌模式动物,由于其与人胰腺癌显示相似的形态,有报告称可用作为药物抵抗性的胰腺癌模型。
3.3. 使用CellSaic作为部件的3D构造
通过使用CellSaic作为部件,可以制作出各种形状。在WO/2017/057547中报告了通过活用CellSaic技术制作1mm以上厚度的片状细胞结构的方法。41)
特别是在MSC中,有时仅有细胞很难切片,但只要利用CellSaic就可能可以得到具有厚度的片状细胞结构。
还有制作更为复杂的结构的方法,像描绘CellSaic的一点一样配制3D结构或将CellSaic嵌入模具做造型的方
法。42),43) 这些技术被认为是利用了由细胞和Scaffold组成的CellSaic(数百μm大小)作为一个点然后进行3D打印的概念。由于CellSaic中含有细胞,随着时间就会与相邻的CellSaic融合,形成一个大的结构体。因此无需粘着剂。也有使用CellSaic制作成试管结构的案例,也有研究称其有可能应用于人工血管等。
◆结论
使用了重组支架的CellSaic作为崭新的细胞移植平台被开发出来。
主要的功能有i). 提高移植细胞的存活率,ii). 提高血管导入率,iii). 细胞因子释放的变化。尤其有助于提高移植细胞的存活率。
以此功能为基础,应用CellSaic于MSC细胞治疗研究中,已有报告称CellSaic对IBD,脑梗塞,骨和软骨再生,胰岛移植等有疗效。关于适用对象,理所当然的考虑到人体治疗以及动物治疗。(Fig2) 以"One Health"的概念为原则,假定MSC CellSaic最初的临床应用是应用于伴侣动物,尤其是狗,进行了canine MSC CellSaic安全性试验。
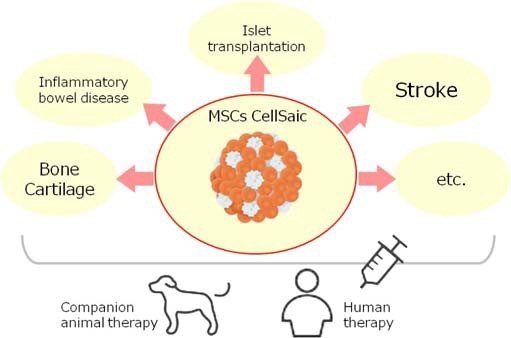
Fig. (2). The application target of MSC CellSaic. Both human and animal therapies are considered as target on the "One Health" concept.
因此,开始了有关病犬的临床研究。今后,这项技术有望为伴侣动物治疗以及人体治疗做出贡献。
◆CONSENT FOR PUBLICATION
Not applicable.
◆CONFLICT OF INTEREST
The authors declare no conflict of interest, financial or otherwise.
◆ACKNOWLEDGEMENTS
The author would like to thank members of the technical staff of Bioscience & Technology Development Center, FUJIFILM Corporation, whose opinions and knowledge were very helpful throughout the completion of this work.
◆参考文献
|
1. |
Langer R and Vacanti JP. Tissue engineering. Science 1993; 260(5110): 920-6. |
|
2. |
Nerem RM, Sambanis A. Tissue engineering: from biology to biological substitutes. Tissue Eng. 1995; 1(1): 3-13. |
|
3. |
Peter SJ, Miller MJ, Yasko AW, Yaszemski MJ, Mikos AG. Polymer concepts in tissue engineering. J Biomed Mater Res 1998; 43(4): 422-7. |
|
4. |
Shoichet MS, Hubbell JA. Polymers for tissue engineering. J Biomater Sci 1998; 9(5): 405-6. |
|
5. |
Chen G, Ushida T, Tateishi T. Scaffold design for tissue engineering. Macromol Biosci 2002; 2(2): 67-77. |
|
6. |
Halme DG, Kessler DA. FDA regulation of stem-cell-based therapies. N Engl J Med 2006; 355(16): 1730-5. |
|
7. |
Cimino M, Goncalves RM, Barrias CC, Martins MCL. Xeno-free strategies for safe human mesenchymal stem/stromal cell expansion: supplements and coatings. Stem Cells Int 2017; 6597815: 1- 13. |
|
8. |
Richards M, Fong CY, Tan S, Chan WK, Bongso A. An efficient and safe xeno-free cryopreservation method for the storage of human embryonic stem cells. Nature 1953; 171(4356): 737-8. |
|
9. |
Trounson A, Thakar RG, Lomax G, Gibbons D. Clinical trials for stem cell therapies. BMC Med 2011; 9(52): 1-7. |
|
10. |
Galipeau J, SensebeL. Mesenchymal stromal cells: Clinical challenges and taherapeutic opportunities. Cell Stem Cell 2018; 22(6): 824-33. |
|
11. |
Ko IK, Kim BG, Awadallah A, et al. Targeting improves MSC treatment of inflammatory bowel disease. Mol Ther 2010; 18(7): 1365-72. |
|
12. |
Caplan AI. Review: Mesenchymal stem cells: Cell based reconstructive therapy in orthopedics. Tissue Eng 2005; 11(7-8): 1198- 211. |
|
13. |
Nitkin CR, Bonfield TL. Concise review: Mesenchymal stem cell therapy for pediatric disease: Perspectives on success and potential improvements. Stem Cells Transl Med 2017; 6(2): 539-65. |
|
14. |
Jurado M, Gil AC, Mata C, et al. A multicenter randomized clinical trial evaluating the safety and feasibility of the treatment of GvHD with allogenic mesenchymal stem cells (MSC) from adipose tissue. Cytotherapy 2017; 19(5): S11. |
|
15. |
Ringdén O, Uzunel M, Rasmusson I, et al. Mesenchymal Stem Cells for Treatment of Therapy-Resistant Graft-versus-Host Disease. Transplantation 2006; 81(10): 1390-97. |
|
16. |
Bahr L, Sundberg B, Lönnies L, et al. Long-term complications, immunologic effects, and role of passage for outcome in mesen- chymal stromal cell therapy. Biol Blood Marrow Transplant 2012; 18(4): 557-64. |
|
17. |
Bhasin A, Srivastava MV, Mohanty S, et al. Stem cell therapy: A clinical trial of stroke. Clin Neurol Neurosurg 2013; 115(7): 1003- 8. |
|
18. |
Wechsler LR, Bates D, Stroemer P, Andrews-Zwilling YS, Aizman I. Cell therapy for chronic stroke. Stroke 2018; 49(5): 1066-74. |
|
19. |
Amado LC, Saliaris AP, Schuleri KH, et al. Cardiac repair with intramyocardial injection of allogeneic mesenchymal stem cells after myocardial infarction. Proc Natl Acad Sci USA 2005; 102(32): 11474-9. |
|
20. |
Martin-Rendon E, Gyongyosi M. Mesenchymal stromal cell therapy as treatment for ischemic heart failure: the MSC-HF study. Cardiovasc Diagn Ther 2017; 7(Suppl. 2): S69-S72. |
|
21. |
Volk SW, Theoret C. Translating stem cell therapies: the role of companion animals in regenerative medicine. Wound Repair Regen 2013; 21(3): 382-94. |
|
22. |
Kahn LH, Kaplan B, Monath TP, Steele JH. Teaching "one medicine, one health". Am J Med 2008; 121(3): 169-70. |
|
23. |
One Health Initiative. [Internet] 2012; cited Dec 12. Available from www.onehealthinitiative.com
|
|
24. |
Yamato M, Okano T. Cell sheet engineering. Materialstoday 2004; 7(5): 42-7. |
|
25. |
Baksh N, Gallant ND, Toomey RG. Cell sheet engineering for integrating functional tissue in vivo: Successes and challenges. MRS Bulletin 2017; 42(5): 350-5. |
|
26. |
Baraniak PR, McDevitt TC. Scaffold-free culture of mesenchymal stem cell spheroids in suspension preserves multilineage potential. Cell Tissue Res 2012; 347(3): 701-11. |
|
27. |
Ylostalo JH, Bazhanov Mohammadipoor N, Bartosh TJ. Production and administration of therapeutic mesenchymal stem/stromal cell (msc) spheroids primed in 3-D cultures under Xeno-free conditions. J Vis Exp 2017; 18(121): doi: 10.3791/55126. |
|
28. |
Yanagihara K, Uchida S, Ohba S, Kataoka K, Itaka K. Treatment of Bone Defects by Transplantation of Genetically Modified Mesenchymal Stem Cell Spheroids. Mol Ther Methods Clin Dev 2018; 9(15): 358-66. |
|
29. |
Nakamura K, Iwazawa R, Yoshioka Y. Introduction to a new cell transplantation platform via recombinant peptide petaloid pieces and its application to islet transplantation with mesenchymal stem cells. Transpl Int 2016; 29(9): 1039-50. |
|
30. |
Nakamura K. Cell construct comprising polymer blocks having biocompatibility and cells. US Patent 2010; US9,597,432. |
|
31. |
Nakamura K, Tabata Y. A new fluorescent imaging of renal inflammation with RCP. J Control Release 2010; 148(3): 351-58. |
|
32. |
Nakamura K, Iwazawa R, Miyoshi H, et al. Cell structure for cell transplantation, biocompatible polymer block, and methods for producing same. International patent publication No. 2013; WO/2014/133081. |
|
33. |
Iwazawa R, Kozakai S, Kitahashi T, Nakamura K, Hata K. The therapeutic effects of adipose-derived stem cells and recombinant peptide pieces on mouse model of DSS colitis. Cell Transplant 2018; [Epub ahead of print]. |
|
34. |
Kozakai S, Nakamura K. Trophic factor release agent and inflammatory disease treatment agent. International patent publication No. 2016; WO2017/221879. |
|
35. |
Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks. WHO technical report series, No 978 Annex 3. 2013. |
|
36. |
Nakamura K. Cell structure for use in treatment of brain injury, method for producing same, and therapeutic agent for brain injury. International patent publication No. 2014; WO2015/194494 |
|
37. |
Miyamoto M, Nakamura K, Shichinohe H, et al. Human Recombinant Peptide Sponge Enables Novel, Less Invasive Cell Therapy for Ischemic Stroke. Stem Cells Int 2018; 4829534: 1-8. |
|
38. |
Naritomi M, Mizuno M, Katano H, et al. Petaloid recombinant peptide enhances in vitro cartilage formation by synovial mesenchymal stem cells. J Orthop Res 2018; In press. |
|
39. |
Nakamura K, Miyoshi H, Hada S, Watanabe M. Cartilage- regenerating material. International patent publication No. 2015; WO2016/148245. |
|
40. |
Nakamura K, Mima S, Kitahashi T, Kakimuma C. Cell structure, non-human mode animal, method for producing non-human model animal, and method for evaluating test substance. International patent publication No. 2015; WO/2017/022613. |
|
41. |
Nakamura K. Method for manufacturing sheet-shaped cell structure, and sheet-shaped cell structure. International patent publication No. 2015; WO/2017/057547. |
|
42. |
Nakamura K. Tublar structure, device for producing tubular structure, and method for producing tubular structure. International patent publication No. 2014; WO/2016/068292. |
|
43. |
Nakamura K, Kuchiishi K, Kizawa H, Aburaya A. Tubular structure, method for producing cell structure, and method for producing tubular structure. Japan patent publication NO. 2015; P2016- 174538A. |
DISCLAIMER: The above article has been published in Epub (ahead of print) on the basis of the materials provided by the author. The Editorial Department reserves the right to make minor modifications for further improvement of the manuscript.
注意:本文的原文为英语,翻译经作者和出版商的许可下,作为参考进行翻译。
请点击文字,浏览相关产品:由人I型胶原蛋白重组多肽形成的新型细胞支架——Cellnest μ-piece
