| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| F015 | UltraRIPA kit for Lipid Raft | 1kit | - | - |
- 产品特性
- 相关资料
- Q&A
- 参考文献
UltraRIPA kit for Lipid Raft![]()
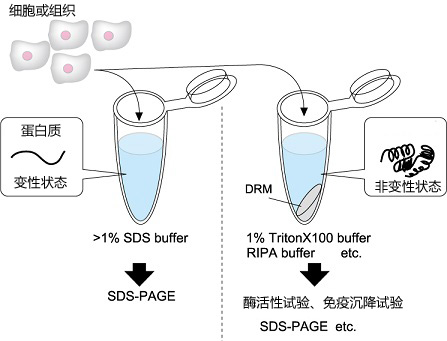
大幅度提升膜蛋白提取效率的新一代RIPA缓冲液
与常规的非变性细胞裂解缓冲液(RIPA buffer, 1% Triton X-100等)相比,这款缓冲液套装(Buffer Kit)能迅速且高效地提取增溶相对困难的脂筏(Lipid Raft)蛋白质。从常规缓冲液中不可溶而丢弃的膜组分中,在维持蛋白质功能的情况下能实现高效地提取,有利于对脂筏等蛋白质的功能分析。
※本产品仅限于研究用。不可用于临床治疗。
◆细胞膜的可溶化和脂筏(Lipid Raft)
裂解细胞进行蛋白质功能分析的时候,经常会使用RIPA (Radio-Immuno Precipitation Assay)缓冲液和1% Triton X-100缓冲液等的相对温和的细胞膜裂解缓冲液。这些缓冲液对蛋白质的构造和功能的影响小,适用于酶活性试验、免疫沉降和各种结合实验等蛋白质的功能分析。另一方面,与具有很强的蛋白质变性作用的SDS缓冲液相比,增溶能力较弱,完全不能溶解以脂筏(Lipid Raft)为主的细胞膜组分。许多表面活性剂都不能溶解脂筏,故其又被称为Detergent Resistant Membrane (DRM)。DRM中所含蛋白质的功能分析被认为是十分困难的。
脂筏(Lipid Raft)是由胆固醇(cholesterol)和鞘磷脂(sphingomyelin),GPI锚定蛋白(GPI anchor protein)和棕榈酰化(palmitoylation)蛋白质组成的细胞膜构造,被认为是整合各种功能蛋白的功能域。神经细胞突触和免疫细胞的免疫突触是脂筏的代表性例子。

脂筏示意图
◆特点
| ● | 操作简单,能快速提取脂筏蛋白 |
| ● | 使用两种类型的缓冲液(A buffer,B buffer)进行两个阶段的提取。先提取出胞浆蛋白和非脂筏蛋白,然后提取脂筏蛋白 |
| ● | Buffer提取的任何蛋白质都不会失活 |
| ● | A buffer和一般的RIPA buffer成分相同*。B buffer含有表面活性剂,可以通过透析除去 |
| ● | 适用于哺乳动物细胞/组织 |
| ● |
使用本品配制的溶解液适用于酶活性试验、免疫沉淀(Immunoprecipitation)、蛋白定量(BCA法)、SDS-PAGE和Western blot等 |
| * |
1% NP-40 Alternative,0.1% SDS,50 mMTris-HCl (pH8.0),150 mMNaCl,0.5% Sodium Deoxycholate |
◆缓冲液套装组成
● A buffer (RIPA buffer) (100 mL)
● B buffer(10 mL)

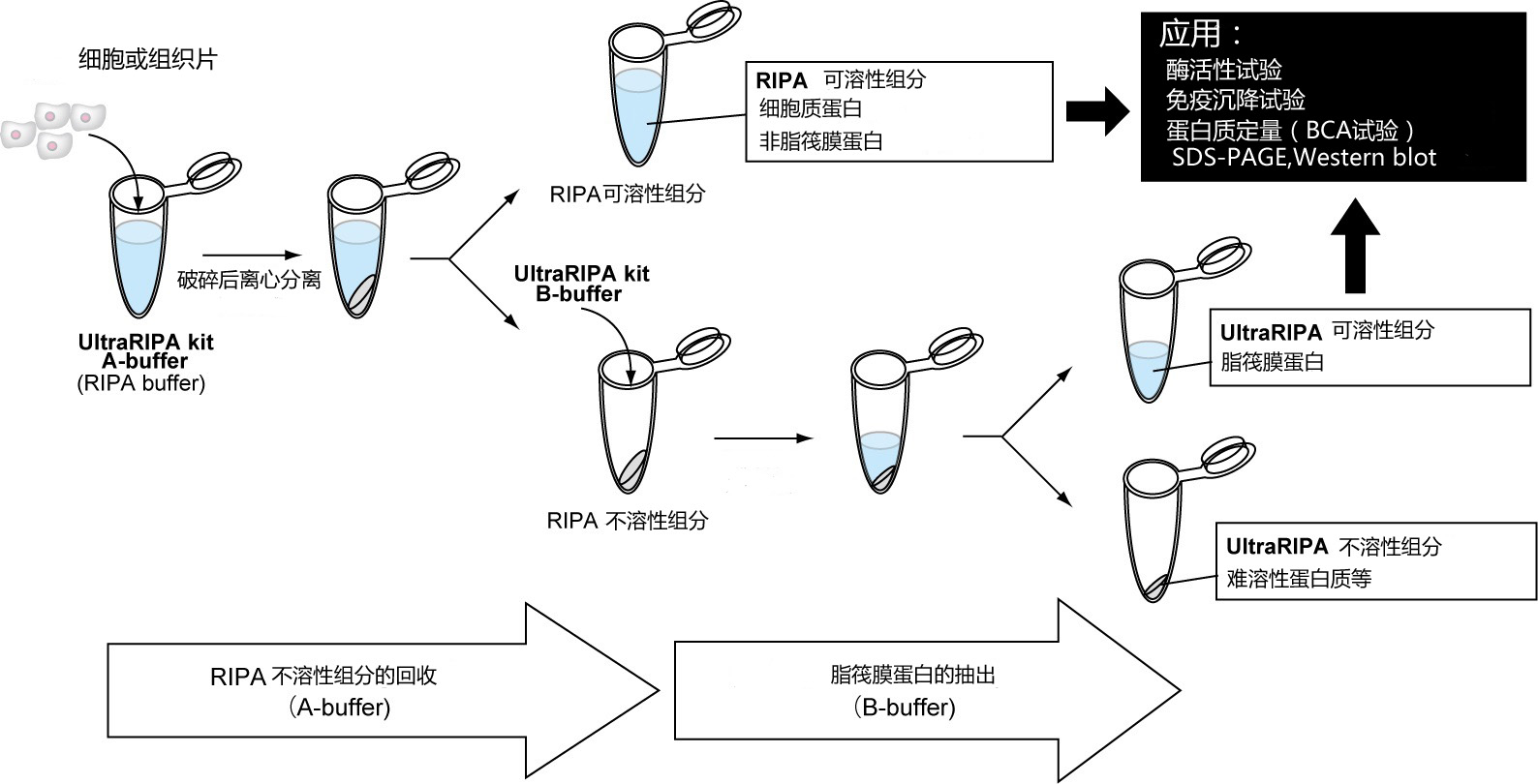
◆使用方法
| 1、 | 用A buffer溶解组织或培养细胞。 |
| ※ | 为了提高溶解效率,推荐使用均质或超声波破碎设备。 |
| 2、 |
进行离心分离,使A buffer中可溶性组分(上层清液)和不溶性组分(沉淀)分离,分别回收。上层清液A buffer可溶性组分中主要含有胞浆蛋白和非脂筏蛋白。 |
| 3、 | 往沉淀的A buffer 不溶性组分中加入B buffer,形成悬浊液。 |
| 4、 | 进行离心分离,与步骤2一样分离出可溶性组分(上层清液)和不溶性组分(沉淀),分别回收。上层清液的B buffer可溶性组分中含有脂筏蛋白。 |
| 5、 | 可应用于各种实验。 |
| ※ | A buffer和B buffer不可用于Bradford法蛋白质定量。蛋白质定量请使用BCA检测。 |
| ※ | 使用本品A buffer和B buffer进行两个阶段的提取是最适宜的,也有只对细胞使用B buffer进行溶解和提取的例子。具体请参照以下例子。 |
UltraRIPA kit 、1% SDS buffer和RIPA buffer的比较
|
蛋白分离 |
蛋白结构 |
蛋白功能 |
应用 |
|||
|
胞质蛋白 |
膜蛋白 |
|||||
|
非脂筏蛋白 |
脂筏蛋白 |
|||||
|
>1%SDS buffer |
○ |
○ |
○ |
╳ |
╳ |
SDS-PAGE |
|
RIPA buffer |
○ |
○ |
╳ |
○ |
○ |
酶分析法测定 免疫沉淀 SDS-PAGE等 |
|
UltraRIPA |
○ |
○ |
○ |
○ |
○ |
|
◆应用例
从脂筏中提取总蛋白
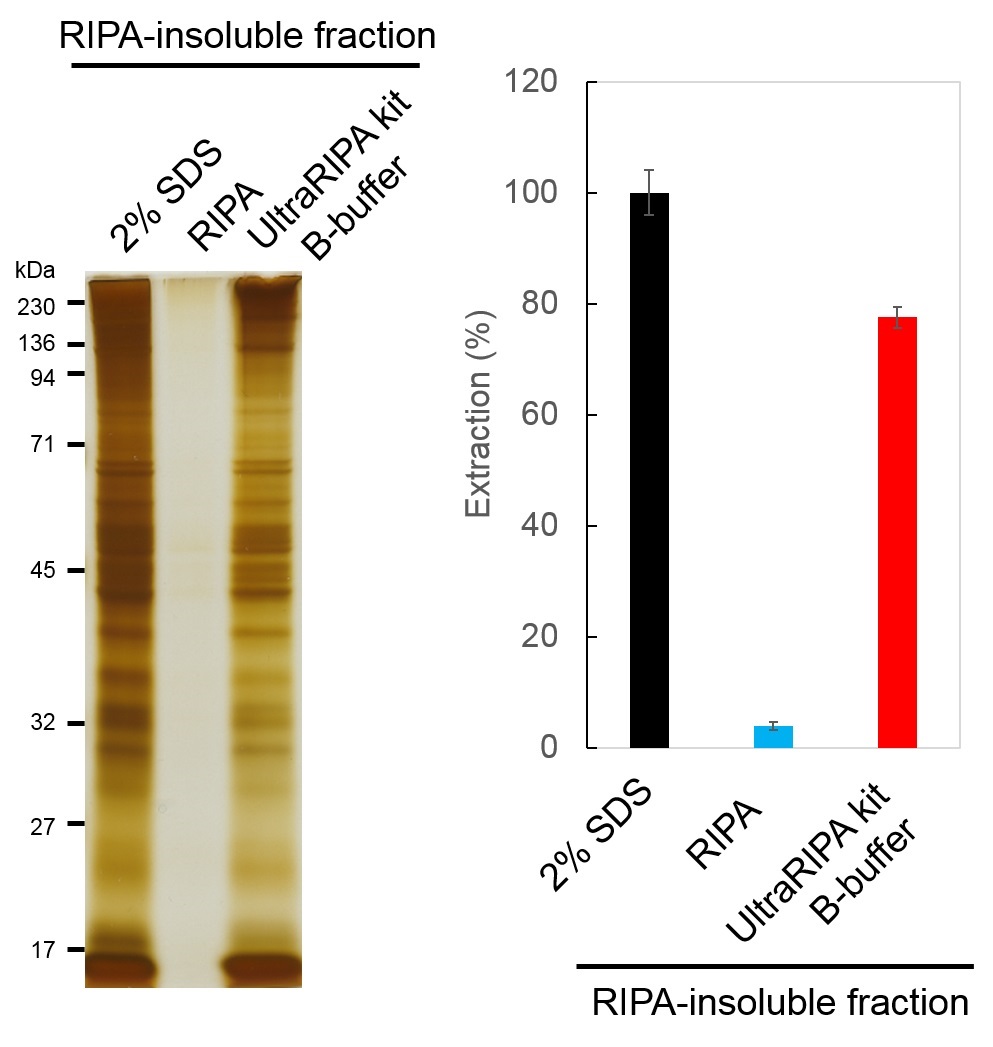
用UltraRIPA kit A buffer溶解小鼠全脑组织后,回收A buffer不溶性组分(RIPA-insoluble fraction),添加2% SDS,RIPA buffer 和UltraRIPA kit B buffer进行提取。提取后的总蛋白用SDS-PAGE/银染色检测(左),用BCA法定量蛋白质(右)。相对于具有很强的蛋白质变性作用的2% SDS缓冲液,UltraRIPA kit能够提取70%以上的蛋白质。
※不能保证全部蛋白质的可溶性都得到改善。
脂筏标记蛋白的提取
用UltraRIPA kit A buffer溶解小鼠全脑组织后,回收A buffer不溶性组分(RIPA-insoluble fraction),添加2% SDS,RIPA buffer 和UltraRIPA kit B buffer,提取后进行SDS-PAGE。利用对应脂筏标记蛋白的抗体进行Western blot检测。
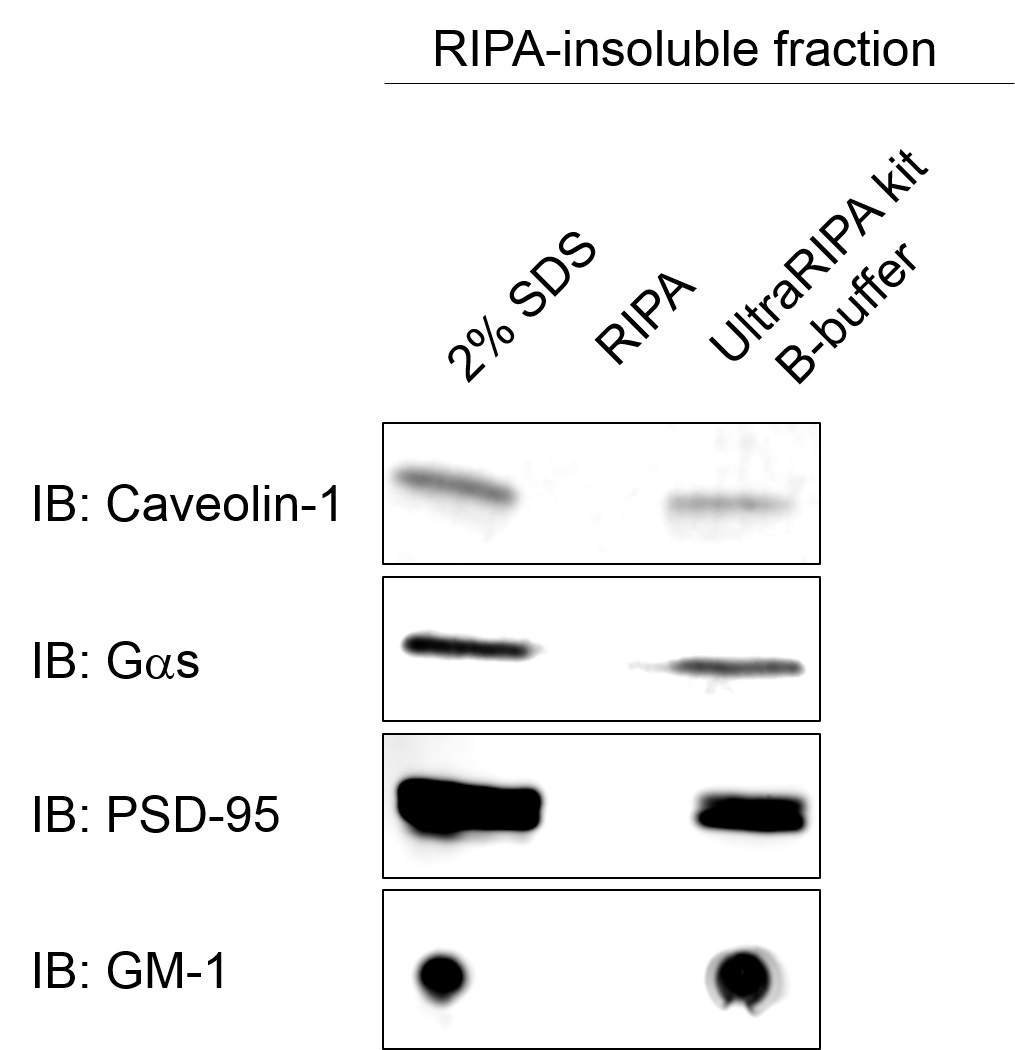
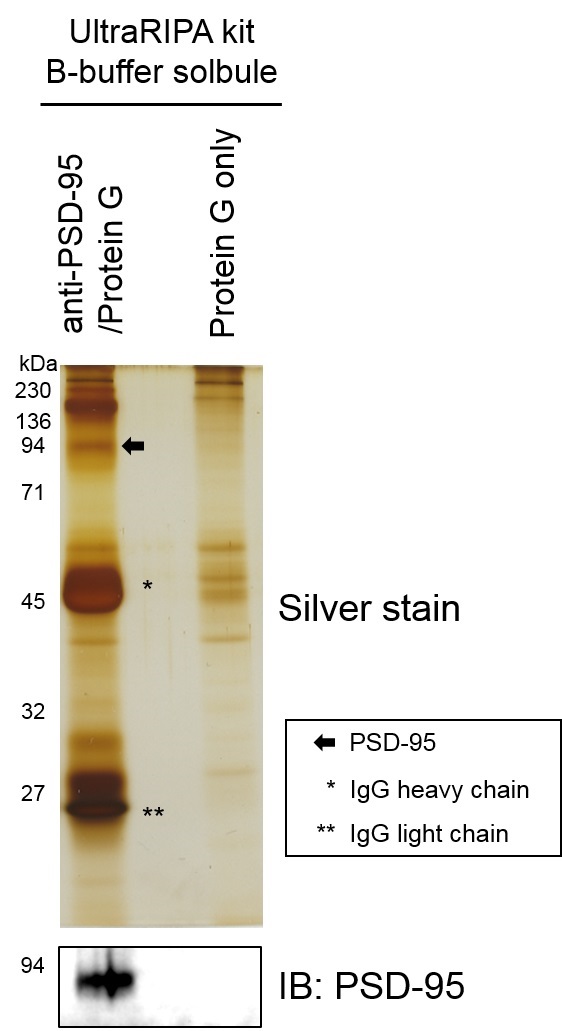
脂筏标记蛋白的免疫沉淀
用UltraRIPA kit A buffer溶解小鼠全脑组织后,回收A buffer不溶性组分,通过B buffer提取脂筏标记蛋白。对 buffer提取物使用脂筏标记蛋白PSD95的抗体和G蛋白偶联磁珠进行免疫沉淀。使用银染色和抗PSD95抗体通过Western blot检测进行确认。
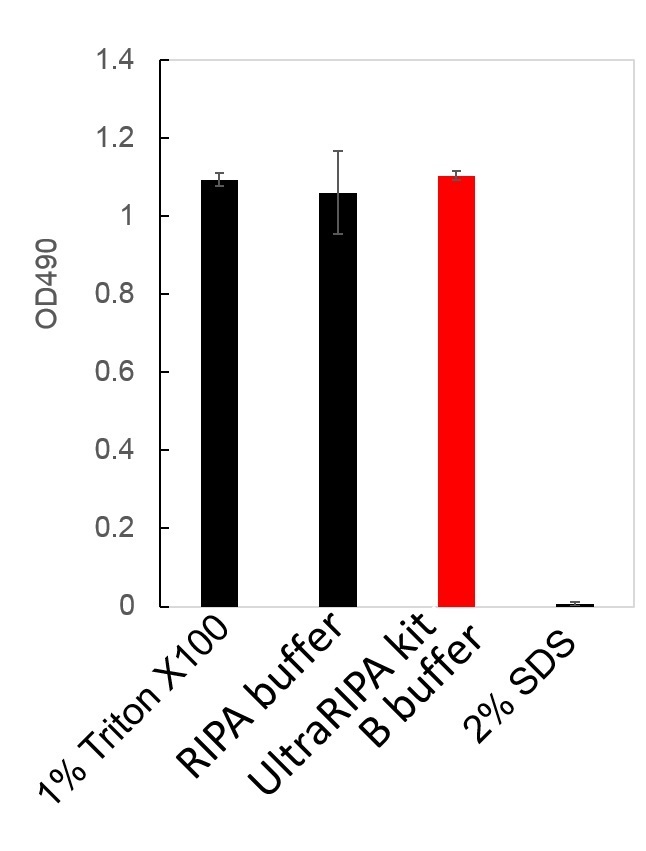
提取的蛋白质的酶活性测定
用1%TritonX100,RIPA buffer,UltraRIPA kit B buffer 和2%SDS溶解CHO细胞,测定溶解物中乳酸脱氢酶(LDH)的活性。2%SDS具有很强的蛋白质变性作用,在几乎完全失活的情况下,1% Triton X100,UltraRIPA kit A buffer,和UltraRIPA kit B buffer所得的酶活性大致相同。
从脂筏中提取功能蛋白
用UltraRIPA kit A buffer溶解小鼠全脑组织后,回收A buffer不溶性组分。用A buffer分三次冲洗不溶性组分,消除RIPA可溶性组分中脱磷酸酶的活性。往不溶性组分中分别添加2% SDS buffer,A buffer(RIPA buffer)和B buffer,测定各种提取物的总脱磷酸化酶活性。下图是各缓冲液从RIPA不溶性组分中提取的蛋白质的量(左轴:黑)和所检测的脱磷酸酶的活性(右轴:红)的示意图。2% SDS buffer能够从RIPA不溶性组分中很好地提取蛋白质,但容易导致蛋白质变性,完全失去脱磷酸化活性。RIPA buffer不能提取蛋白质,活性也无法检测。UltraRIPA kit B buffer所提取的蛋白质大约为2% SDS buffer的70%,且可以检测出较强的脱磷酸化活性。

UltraRIPA kit B buffer单独提取脂筏蛋白的可能性评价
※数据提供:东京大学药学院研究生院保健化学系
用PBS冲洗COS-1细胞,分别使用SDS buffer,1% Triton X-100 buffer,UltraRIPA kit A buffer 和UltraRIPA kit B buffer裂解,通过离心分离(14,000 rpm, 5 min,4℃)可溶性组分和不可溶性组分。不可溶性组分用等量的SDS-PAGE样品缓冲液变性溶解。脂筏标记Flotilin1的可溶部分通过SDS-PAGE/western blot测定。使用1% Triton X-100和RIPA buffer,大部分的Flotilin 1不溶性膜组分没有被溶解,而UltraRIPA kit B buffer几乎可以全部溶解。

◆各buffer组成
| ● | SDS buffer(2%SDS, 1% Triton X-100, 50 mM HEPES・Na (pH 7.2), 150 mMNaCl) |
| ● |
UltraRIPA kit A buffer (1% NP-40 Alternative,0.1% SDS,50 mMTris-HCl (pH8.0),150 mMNaCl, 0.5% Sodium Deoxycholate) |
| ● | UltraRIPA kit B buffer (成分保密) |
| ● | 1% Triton X-100 (1% Triton X-100, 50 mM HEPES・Na (pH 7.2), 150 mMNaCl) |
欲了解更多相关产品信息,请点击文字:ULTRARIPA® Kit 应用数据
相关资料

UltraRIPA kit for Lipid Raft
|
Q-1. |
如果单独使用B缓冲液,溶解效率是否高于RIPA缓冲液? |
|
A-1. |
B缓冲液的溶解活性比RIPA(A缓冲液)高。本试剂盒的操作分为2个阶段,首先将RIPA不溶性组分回收并用B缓冲液将其溶解,并以浓缩和简单提取RIPA不溶性组分中含有的脂筏蛋白为目的而进行第2阶段的操作。但是,如果是直接用B缓冲液处理样本的时候,溶解率的确比RIPA高。 |
|
Q-2. |
使用ULTRARIPA® Kit是否只可以提取脂筏蛋白? |
|
A-2. |
多数研究认为,脂筏的细胞膜穴样内陷和神经突触中含有的组成蛋白不能用Triton X-100等温和的表面活性剂溶解,因此认为表面活性剂的不溶性组分(DRM)是生化脂质筏。本产品着眼于RIPA不溶性组分富含的脂筏蛋白,用B缓冲液进一步使其溶解,使得脂筏蛋白在非变性状态下溶解。因此,即使不是脂筏,只要是不溶于RIPA的样本,都可以使用本试剂盒进行检测(关于核蛋白的污染参见Q-3)。本试剂盒使用溶解能力较高的RIPA缓冲液作为A缓冲液,但是也可以用1% Triton X-100等的裂解缓冲液代替RIPA缓冲液。 |
|
Q-3. |
推荐使用均质或超声破碎设备,单独使用涡旋和移液是否不够充分? |
|
A-3. |
本产品采用A缓冲液溶解后离心,并回收RIPA不溶性组分这样简单的步骤。因此,如果有细胞/组织的未破碎物或核残留的话,则可能污染RIPA不溶性组分。特别是RIPA缓冲液的核溶解效率较弱,如果不添加物理破碎,则核可能会大量残留在RIPA不溶性组分中。另一方面,由于B缓冲液的核溶解率较高,如果有核残留的话就会释放出DNA,使溶液变浑浊。在A缓冲液溶解时进行超声处理的话可以破坏核以及使基因组DNA片段化。核的污染可能会影响后续的应用,因此,我们强烈推荐使用均质或超声破碎设备。 |
|
Q-4. |
B缓冲液的成分是什么种类的表面活性剂。听说表面活性剂的种类会影响电泳,我想知道它的成分。 |
|
A-4. |
非常抱歉,B缓冲液的成分是非公开的。 我们无法告诉您表面活性剂的种类。然而,我们可以确定B缓冲液不会影响电泳。 |
|
Q-5. |
几乎无法看见A不溶性组分。即使添加了B缓冲液也无法获取蛋白质量,怎么办? |
|
A-5. |
RIPA缓冲液可以溶解90~95%包括膜蛋白在内的总蛋白(根据组织/细胞种的不同多少会有点差别)。因此,考虑蛋白质总量时,RIPA不溶性组分中含有的蛋白为样本总体的10%以下。肉眼无法看见RIPA不溶性组分时,需要增加细胞数/组织量。想要提高B缓冲液溶解组分蛋白浓度时,减少添加至RIPA不溶性组分的B缓冲液的量就可以得到改善。我们建议您可以设置如下的阳性对照。 |
| 探讨样本量的阳性对照实验
需要准备的试剂:2% SDS缓冲液(50 mM Tris-HCl(pH 8.0),150 mM NaCl,2% SDS) 步骤:回收RIPA不溶性组分后,添加2%SDS缓冲液,通过进行蛋白质定量检测,可以预估RIPA不溶性组分中含有的蛋白质总量。 |
|
|
Q-6. |
在A缓冲液溶解组分中可以观察到脂筏标记物,有什么改善的方法吗。 |
|
A-6. |
我们无法保证在其他方法中作为脂筏标记物被检测出的蛋白能否在A缓冲液不溶性组分中获得。特别是根据脂筏标记物的不同,细胞种类/组织,有无外部信号也会有变动。我们会根据以下案例提供相关的改善方法,请酌情参考。 例1:不溶于1%Triton X-100,但用RIPA缓冲液可以检测出可溶性组分。 改善方法:可能是由于RIPA缓冲液(1%NP-40,0.1% SDS,0.5% sodium deoxycholate)的提取效率比1%Triton X-100强,所以能将其溶解。这时候,可以通过用1%Triton X-100缓冲液代替A缓冲液来浓缩以及溶解目的蛋白。 例2:离心条件不足时,虽然不溶解,但是不沉淀。 改善方法:虽然我们推荐的离心条件为10,000×g,但是根据目的蛋白的不同,离心10,000×g可能不足。这时,也有把离心条件调整为20,000×g之后得到改善的案例。因此,我们建议您可以探讨一下离心条件。 |
|
Q-7. |
用B缓冲液洗脱的蛋白可以用于质谱分析吗? |
|
A-7. |
B缓冲液溶解的蛋白经过SDS-PAGE分离后,可以通过一般的蛋白质组学分析的顺序(切割凝胶,在凝胶中进行胰蛋白酶消化,提取肽以及脱盐操作)进行分析。 |
|
Q-8: |
用B缓冲液提取后,我想用适合试验的缓冲液来置换它。 可以通过透析去除B缓冲液的表面活性剂吗? |
|
A-8: |
B缓冲液含有的表面活性剂可以通过透析去除。请使用孔径为5 kDa的透析膜。但是,也有根据蛋白质的不同,在去除表面活性剂时也可能会聚集或变性,需要添加别的表面活性剂到透析缓冲液中。建议进行预实验。 |
Taruno A, Sun H, Nakajo K, et al. Post-translational palmitoylation controls the voltage gating and lipid raft association of CALHM1 channel. [J]. Journal of Physiology, 2017, 595(18).
jQuery(“.nltabbox”).slide({effect:”fade”});
